Derya_Hoca Tarafından Sorulan Soru
Soru:
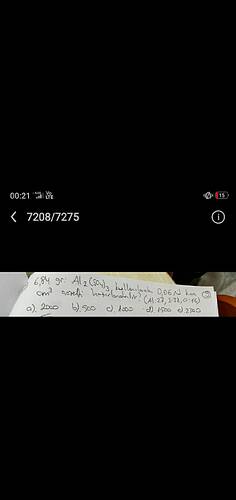
6,84 gr Al2(SO4)3 kullanılarak 0,06 N kaç cm³ asidik hazırlanabilir? (Al: 27, S:32, O:16)
a) 2000 b) 500 c) 1000 d) 1500 e) 2800
Cevap:
Adım 1: Al2(SO4)3’ün Mol Kütlesini Hesaplayalım
-
Al2(SO4)3 formülündeki atomların mol kütlelerini ele alalım:
- Al: 2 atom x 27 g/mol = 54 g/mol
- S: 3 atom x 32 g/mol = 96 g/mol
- O: 12 atom x 16 g/mol = 192 g/mol
-
Al2(SO4)3’ün toplam mol kütlesi:
54 + 96 + 192 = 342 \, \text{g/mol}
Adım 2: Kullanılan Al2(SO4)3’ün Mol Sayısını Bulalım
- 6,84 gr Al2(SO4)3 kullanılmıştır:\text{Mol sayısı} = \frac{6,84 \,\text{g}}{342 \,\text{g/mol}} = 0,02 \,\text{mol}
Adım 3: Asidik Çözeltinin Normalitesini Hesaplayalım
-
Al2(SO4)3’ün suda çözündüğünde oluşturduğu sülfat iyonları SO4^2- başına 2H+ iyonu verebilir. Al2(SO4)3 çözeltisinde toplam 6 hidrojen ayrılır.
-
Normalite (N), eşdeğer gram sayısını 1000’e bölümüdür:
\text{Eşdeğer gram sayısı} = 0,02 \,\text{mol} \times 6 = 0,12 \,\text{eşdeğer} -
0,06 N hazırlandığında:
0,12 \,\text{eşdeğer} = 0,06 \,\text{N} \times \text{hacim (L)}\text{Hacim (L)} = \frac{0,12}{0,06} = 2 \,\text{L}
Adım 4: Hacmi cm³’e Çevirme
- Hacimi cm³’e çevirmek için 1000 ile çarpılır:2 \,\text{L} = 2000 \,\text{cm}^3
Sonuç:
6,84 gr Al2(SO4)3 kullanarak 0,06 N konsantrasyonda 2000 cm³ asidik çözelti hazırlanabilir.
Doğru Cevap: a) 2000