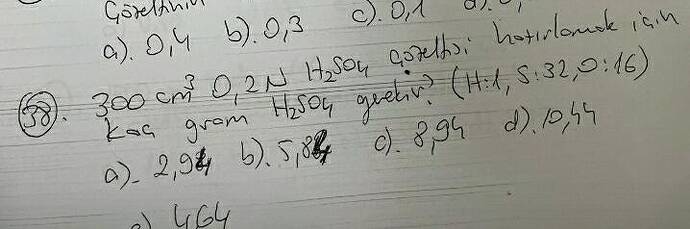300 cm³ 0.2 N H₂SO₄ çözeltisi hazırlamak için kaç gram H₂SO₄ gerekir?
Cevap:
Verilenler:
- Çözeltinin hacmi = 300 cm³ (0.3 L)
- Normalite (N) = 0.2 N
- H₂SO₄’ün mol kütlesi = 2(1) + 32 + 4(16) = 98 g/mol
Normalite ve mol kütlesi ilişkisi:
Normalite (N), bir çözeltide çözeltinin belirli bir hacimde ne kadar eşdeğer madde içerdiğinin bir ölçüsüdür. Sülfürik asit (H₂SO₄), iki bazik eşdeğerlik sağlayan diprotik bir asittir. Bu nedenle, molarite (M) ve normalite (N) arasındaki ilişki:
N = M \times n \quad \text{(n: 1 mol H₂SO₄'ün verdiği eşdeğer sayısı)}
Burada, n = 2 olduğuna göre:
N = M \times 2
M = \frac{N}{2} = \frac{0.2}{2} = 0.1 \, \text{mol/L}
Mol sayısını bulma:
Çözeltinin hacmi: 0.3 L (300 cm³)
n = M \times V = 0.1 \text{mol/L} \times 0.3 \, \text{L} = 0.03 \, \text{mol}
Kütle hesaplaması:
Mol sayısı ve molar kütle bilindiğine göre, kütle hesaplanabilir:
\text{kütle} = n \times \text{molar kütle} = 0.03 \, \text{mol} \times 98 \, \text{g/mol} = 2.94 \, \text{g}
Sonuç:
- Doğru cevap a) 2.94 gram olarak hesaplanır.