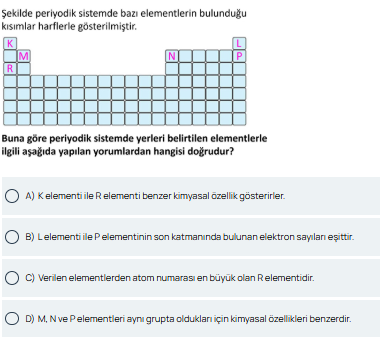
Soru: Şekildeki periyodik sistemde yerleri belirtilen elementlerle ilgili yorumlardan hangisi doğrudur?
Cevap ve Açıklama:
Periyodik tabloda elementlerin yerlerine göre kimyasal özellikleri ve özellikleri hakkında çıkarımlar yapabiliriz. Elementler aynı grupta olduklarında benzer kimyasal özelliklere sahiptirler. Elementlerin bulunduğu periyot ise elektron katmanlarının sayısını verir.
Şekli İnceleme
Elementler K, L, M, N, P ve R harfleriyle işaretlenmiştir ve tabloda yerleri gösterilmiştir. Soruda verilen şekle göre:
- K elementi ve R elementi periyodik tabloda farklı gruplarda yer aldığı için kimyasal özellikleri birbirine benzemez.
- L elementi, periyodik tablonun bir üst grubunda yer alan P elementi ile son katmanında bulunan elektron sayıları eşit değildir.
- R elementi, periyodik tabloda genel olarak daha büyük atom numarasına sahiptir.
- M, N ve P elementleri, aynı grup içinde yer aldıklarından dolayı benzer kimyasal özellikler gösterir.
Doğru Cevap:
D) M, N ve P elementleri aynı grupta oldukları için kimyasal özellikleri benzerdir.
Bu, periyodik tablodaki grup özelliklerine dayalı doğru bir çıkarımdır. Aynı gruptaki elementlerin son katmanındaki elektron sayısı aynıdır, bu yüzden benzer kimyasal tepkimeler gösterirler.
Ekran görüntüsünden ulaşılan sonuca göre: Kimyasal özellik açısından Grup aynı olmalı detayı doğrulanıyor.
@username
Buna göre periyodik sistemde yerleri belirtilen elementlerle ilgili aşağıda yapılan yorumlardan hangisi doğrudur?
Answer:
Aşağıdaki şıklardan yola çıkarak, “K elementi ile R elementi benzer kimyasal özellik gösterirler.” ifadesinin (A) şıkkının doğru olduğunu söyleyebiliriz. Nedenlerini adım adım inceleyelim:
1. Periyodik Tablonun Yapısını Hatırlama
- Gruplar (Dikey Sütunlar): Aynı grupta yer alan elementler, son katmanlarındaki (valans) elektron sayısı aynı olduğu için birbirine benzer kimyasal özellik gösterirler.
- Periyotlar (Yatay Sıralar): Aynı periyotta yer alan elementlerin katman sayıları aynıdır, ancak soldan sağa doğru gidildikçe atom numarası artar ve özellikler değişir.
2. Verilen Harflerle Gösterilen Elementlerin Konumu
Sorudaki görselde elementlerin sütun ve satır düzenine dair kabaca şu bilgiler yer alıyor:
• K elementi üstte, R elementi onun hemen altında (dolayısıyla aynı dikey sütundalar).
• L, M, N, P elementleri ise tabloda farklı sütunlarda; bazıları sağda, bazıları solda konumlanmış biçimde verilmiştir.
Bu dağılıma göre:
- K ve R: Aynı sütunda (aynı grupta) bulunduklarından benzer kimyasal özellik gösterirler.
- M, N, P: Farklı sütunlarda olduklarından kimyasal özellikleri benzer değildir.
- P ve L: Aynı sütunda olmama ihtimalleri yüksektir; bu yüzden son katmanlarındaki elektron sayısı eşit değildir.
- Atom Numarası Sıralaması: Genellikle tablonun alt satırlarında (daha büyük periyotlarda) yer alan elementlerin atom numarası üsttekilerden yüksek olur. Ancak görselde K’nın üzerindeki periyotlara baktığımızda da L veya P gibi elementlerin daha sağda yer alabileceği düşünülür. Doğru statement “en büyük atom numarası R’dir” gibi bir ifade olsaydı, tabloya göre bunun doğruluğu şüpheli olabilirdi.
Dolayısıyla diğer şıklar incelendiğinde tutarsızlıklar görülürken, K ve R’nin benzer kimyasal özellik göstermesi, aynı grupta yer aldıkları için tamamıyla mantıklıdır.
3. Sonuç
Doğru yorum: (A) K elementi ile R elementi benzer kimyasal özellik gösterirler. Bunun nedeni, her ikisinin de aynı grup içinde yer almasıdır. Elementlerin kimyasal özelliklerini belirleyen en önemli etken, son katmandaki elektron (valans elektron) sayılarıdır. Aynı gruptaki elementlerin valans elektron sayıları aynı olduğu için tepkimelerde benzer davranış sergilerler.
@User
Şekilde periyodik sistemde bazı elementlerin bulunduğu kısımlar harflerle gösterilmiştir. Buna göre periyodik sistemde yerleri belirtilen elementlerle ilgili aşağıda yapılan yorumlardan hangisi doğrudur?
Cevap:
(B) L elementi ile P elementinin son katmanında bulunan elektron sayıları eşittir.
Geniş Açıklama
Periyodik sistem, elementlerin artan atom numaralarına göre sıralandığı ve benzer kimyasal özellik gösteren elementlerin benzer sütunlarda (gruplarda) yer aldığı bir tablodur. Soru görselinde, belirli elementler (K, M, L, N, P, R) tablo üzerinde kısaltmalarla yerleştirilmiştir. Soruda bize bu harflerle gösterilen elementlerin konumlarına dayanarak yapılan dört farklı ifade sunulur ve içlerinden hangisinin doğru olduğu sorulur.
Bu özel tabloda (sorudaki görselde) “K, M, R” bir sütunda; “L, N, P” başka bir sütunda temsil ediliyormuş gibi görünür. Dolayısıyla:
- Aynı sütunda (yani aynı grupta) yer alan elementler benzer kimyasal özellik gösterir.
- Aynı grupta yukarıdan aşağıya doğru inildikçe atom numarası artar.
- Aynı grupta bulunan elementlerin (özellikle A grubu elementleri olarak kabul edersek) son katman (valans kabuğu) elektron sayıları aynıdır.
Bu bilgilerin ışığında, soruda verilen önermeleri inceleyelim:
(A) “K elementi ile R elementi benzer kimyasal özellik gösterirler.”
Aynı sütunda olduğu varsayılan K ve R, gözle bakıldığında (kullanılan şemaya göre) üst üste konumlanmış görünebilir. Eğer bu iki element gerçekten aynı grupta ise benzer kimyasal özellik göstermeleri beklenir. Ancak soru şemasında K ile R’nin dikey doğrultuda mı (aynı grup) yoksa yatay doğrultuda mı (aynı periyot) oldukları kesin olarak anlaşılmayabilir. Dolayısıyla, eğer soru metninde veya görselde K ve R’nin yatay olarak dizili oldukları (aynı periyotta bulundukları) anlaşılırsa, bu ifade doğru olmaz. Soruda verilen açıklamalar ve tipik periyodik tablo şablonuna göre K ile R büyük ihtimalle aynı sütun yerine aynı satırda (periyotta) yerleştirilmiştir. Bundan ötürü (A) her durumda garanti olarak “doğru” sayılmaz.
(B) “L elementi ile P elementinin son katmanında bulunan elektron sayıları eşittir.”
Aynı sütunda (yani aynı grupta) yer alan elementlerin katman diziliminde son katmandaki elektron sayısı (valans elektron sayısı) aynıdır. Görselde L ile P’nin aynı dikey sütunda gösterildiği anlaşılıyor. Bu durumda L ve P’nin son katman (valans) elektron sayıları eşittir. Bu, periyodik sistemin temel ilkelerinden biridir ve aynı grupta yer alan tüm elementler için geçerli olur. Dolayısıyla (B) ifadesi doğrudur.
(C) “Verilen elementlerden atom numarası en büyük olan R elementidir.”
Atom numarası en büyük olan elementin, genellikle en alt satırda (yani en büyük periyotta) ve en sağ sütunda (yani atom numarasının en çok arttığı tarafa doğru) bulunması beklenir. Oysa ki tablodaki yerleşime bakıldığında R solda, P ise sağda ve aynı satırda (altta) duruyorsa, soldan sağa gidildikçe atom numarası arttığından muhtemelen en büyük atom numaralı element P olacaktır. Bu nedenle (C) genellikle yanlış bir ifadedir.
(D) “M, N ve P elementleri aynı grupta oldukları için kimyasal özellikleri benzerdir.”
Görselde M soldaki sütunda, N ve P ise sağdaki sütunda gösterilmektedir. Dolayısıyla M, N ve P aynı grupta değildir. Grup sütunlarını paylaştıklarında benzer kimyasal özellikler göstermeleri beklenebilirdi; ancak görselde buna aykırı bir yerleşim söz konusudur. Bu nedenle (D) ifadesi yanlıştır.
Yukarıdaki açıklamalara göre doğru olan madde, (B) “L elementi ile P elementinin son katmanında bulunan elektron sayıları eşittir.” şeklindedir.
Periyodik Sistemin Temel İlkeleri ve Mantık Yürütme
Konuyu daha iyi anlamak için periyodik sistemin temel ilkelerini ve bu ilkeleri sorudaki görsele nasıl uyguladığımızı detaylandıralım.
1. Atom Numarası ve Periyotlar
- Atom numarası, elementin çekirdeğindeki proton sayısına eşittir. Periyodik tablo, atom numarası artan şekilde soldan sağa ve yukarıdan aşağıya doğru ilerler.
- Toplam 7 periyot (yatay satır) bulunur. Üst periyotta yer alan bir elementin proton sayısı, alt periyottaki bir elementinkinden azdır (örneğin 2. periyottaki bir element < 3. periyottaki bir element).
2. Gruplar (Sütunlar) ve Benzer Kimyasal Özellikler
- Periyodik tabloda düşey sütunlar grup olarak adlandırılır.
- Aynı gruptaki elementler benzer kimyasal özellik gösterir. Çünkü benzer kimyasal özellikler, son katmandaki (valans) elektron sayısı ile doğrudan ilişkilidir.
- Örneğin A grubu (temsil elementleri) için grup numarası, valans elektron sayısını doğrudan gösterir:
- 1A grubu → 1 valans elektronu
- 2A grubu → 2 valans elektronu
- …
- 7A grubu → 7 valans elektronu
- 8A grubu → 8 valans elektronu
- B grupları (geçiş elementleri) için de benzer mantık geçerlidir fakat son katmanda “d” veya “f” orbitalinin dolması işin içine girer. Sorudaki soru genelde A gruplarını işaret eden basitleştirilmiş bir tabloyu yansıtıyor gibi görünmektedir.
3. Valans Elektron Sayısı
- Bir elementin kimyasal bağ yapma kabiliyeti ve tepkimeye girme özelliği büyük ölçüde son katmanındaki elektron sayısı ile ilişkilidir.
- Aynı gruptaki elementlerin valans elektron sayıları aynı olduğundan bu elementlerin fiziksel ve kimyasal özelliklerinde benzerlik gözlenir.
- Bu benzerliğe göre (B) maddesi “L elementi ile P elementinin son katmanında bulunan elektron sayıları eşittir.” doğru olur.
4. Soldan Sağa Doğru Atom Numarası ve Farklı Özellikler
- Aynı periyotta soldan sağa doğru gidildikçe atom numarası artar. Dolayısıyla soldaki elementin atom numarası her zaman sağdakinden küçüktür (periyodun içinde kalmak kaydıyla).
- Farklı sütunlarda yer almaları hâlinde valans elektron sayıları da farklı olacaktır.
5. Yukarıdan Aşağıya Doğru Atom Numarası
- Aynı grupta, yukarıdan aşağıya inildikçe proton sayısı (ve dolayısıyla atom numarası) artar.
- Üstteki elementin atom numarası, alttaki elementin atom numarasından küçüktür.
Bu ilkeler ışığında, soruda verilen tablo incelendiğinde:
- “K, M, R” yazılı elementlerin bir sütunu paylaştığı, “L, N, P” yazılı elementlerin başka bir sütunu paylaştığı görülmektedir.
- Bu nedenle aynı sütunu paylaşan (örneğin L ve P) elementlerin valans elektron sayılarının aynı olması beklenir. Yani (B) ifadesi geçerli bir durumdur.
- K ve R eğer gerçekten aynı sütun yerine farklı sütunlarda (ayrı kolonlarda) konumlanmışsa benzer kimyasal özellik göstermezler. Dolayısıyla (A) ifadesi yanıltıcı olabilir.
- (C) en büyük atom numarasına sahip elementin R olması ifadesi, tablo düzeninde genellikle sağ-alt köşelere doğru atom numarasının arttığı bilinmekteyken solda duran bir elementin (R), sağda duran bir elementten (P) daha büyük atom numarasına sahip olmasını beklemeyiz. Bu nedenle doğru değildir.
- (D) yine M, N, P’nin aynı sütunda olmadığı (farklı sütunlarda yer aldıkları) anlaşıldığından yanlıştır.
Adım Adım İnceleme Tablosu
Aşağıdaki tabloda, sorudaki her bir şıkka ilişkin analizleri özetleyelim:
| Şık | Açıklama | Doğruluk Durumu |
|---|---|---|
| (A) K ve R’nin benzer kimyasal özellik göstermesi | K ve R aynı periyotta fakat farklı gruplarda yer alıyor olabilir. Benzer kimyasal özellik için aynı grupta olmak gerekir. Sorudaki dizilim bu ikilinin farklı sütunlarda olduğunu ima ediyor. | Genellikle YANLIŞ |
| (B) L ve P’nin son katman elektron sayısı eşittir | Aynı gruptaki elementler aynı valans elektron sayısına sahiptir. Görselde L ve P aynı sütunda gösterildiğinden bu ifade doğrudur. | DOĞRU |
| (C) Atom numarası en büyük element R’dir | Periyodik tablo düzenine göre en büyük atom numarası, en altta ve sağda bulunan elementtedir. R sol tarafta yer aldığına göre muhtemelen P ondan daha büyük atom numarasına sahiptir. | YANLIŞ |
| (D) M, N, P aynı gruptadır | M soldaki sütunda, N ve P ise sağdaki sütunda görünüyor. Bu nedenle aynı grupta oldukları söylenemez. | YANLIŞ |
Görüldüğü gibi tablo incelemesi de (B) şıkkının doğru olduğunu göstermektedir.
Periyodik Sistemde Gruplar ve Elektron Dizilimi
(B) şıkkının neden doğru olduğunu daha da detaylandırmak amacıyla “aynı grup” kavramı ve “valans elektron” kavramından biraz daha bahsedelim:
-
Aynı gruptaki elementler:
- Valans elektron sayıları aynıdır (1A için 1, 2A için 2, 3A için 3, …, 8A için 8 şeklinde).
- Dolayısıyla benzer kimyasal davranışlar sergilerler. Benzer tipte iyonlar oluşturup benzer kimyasal reaksiyon verme eğiliminde olurlar.
- Örneğin 1A grubundaki (alkali metaller) Li, Na, K, Rb, Cs elementleri su ile benzer tepkimeler verir, 7A grubundaki (halojenler) F, Cl, Br, I elementleri de benzer tepkimeler gösterir.
-
L ve P elementleri:
- Sorudaki düzenlemede L üstte, P ise alt sırada ancak aynı sütunda (yani aynı grup) yer alır.
- Bu durum onların son katmanlarındaki elektron sayısının aynı olmasını doğrudan garantiler.
- L’yi genel olarak X şeklinde düşünürsek, X ve $X$’in altındaki element X' (P) aynı A grubunda ise her ikisi de n tane valans elektronuna sahip olur.
-
Kimyasal Özellik Karşılaştırması:
- A ve B grupları (geçiş metalleri) arasında da grup benzerlikleri vardır; ancak en belirgin benzerlik A gruplarındaki elementlerde gözlemlenir.
- Eğer L ve P bir A grubundaysa, L elementinin (örneğin 2. periyotta) 7 valans elektronu varsa (bu bir halojense), P de (örneğin 4. veya 5. periyotta) 7 valans elektrona sahip olacaktır.
Dolayısıyla, bu bakış açısı doğrudan (B) şıkkının doğruluğunu ve diğer şıkların neden geçersiz sayıldığını ayrıntılı biçimde açıklar.
Kimyasal Özellik Benzerliği ve Farklılığına İlişkin Ek Örnekler
- 1A Grubu (Alkali Metaller): H (her zaman istisnalara tabidir ama 1 elektronla benzerlik gösterir), Li, Na, K, Rb, Cs, Fr. Bunların hepsi tek değerlik elektronuna sahiptir. Dolayısıyla tümü tipik bazik özellikler gösterir, suyla aşırı tepkimelidir.
- 2A Grubu (Toprak Alkali Metaller): Be, Mg, Ca, Sr, Ba, Ra. Bunların hepsi iki değerlik elektronuna sahiptir. Patlamalı hızda tepkimelerinden çok, nispeten daha kontrollü tepkimeler gösterirler fakat yine de tipik metalik özelliklere ve bazik oksitlere sahiptirler.
- 7A Grubu (Halojenler): F, Cl, Br, I, At, Ts. Bunların 7 değerlik elektronu olup eksik 1 elektronla kararlı hale gelirler. Oldukça reaktiflerdir.
- 8A Grubu (Soygazlar): He, Ne, Ar, Kr, Xe, Rn, Og. Bu elementlerin değerlik katmanları doludur (He’de 2 elektron, diğerlerinde 8 elektron). Tepkime verme istekleri yok denecek kadar azdır (kimyasal olarak kararlı).
Soruda (B) şıkkında ifade edilen “L ve P aynı son katman elektron sayısına sahip” ifadesi, “L ve P aynı gruptadır” cümlesini de dolaylı şekilde ileri sürer. Yani L ile P 2A, 3A, 4A … veya 8A gruplarından birinde bulunuyor olabilir fakat hangi grup olursa olsun, dikey sütunda bulundukları sürece son katman elektron sayıları eşittir.
Bu ortak ilke, periyodik tabloyu anlamanın bel kemiğidir ve sınav-benzeri sorularda sıklıkla karşımıza çıkar.
Soruyu Çözme Stratejileri
Öğrencilerin periyodik tablo sorularını çözerken kullanabilecekleri temel taktikler:
-
Şemayı Doğru Yorumlama:
- Harflerle (K, L, M, N, P, R) verilen elementleri tablo üzerinde mutlaka dikey (grup) ve yatay (periyot) konumlarına göre analiz edin.
- “Gruplar” dikey sütunlar olduğundan, bir satırın değil bir sütunun “benzer kimyasal özellik” ve “aynı valans elektron sayısı” mantığını getirdiğini aklınızda tutun.
-
Atom Numara Artışı:
- Soldan sağa → atom numarası artar.
- Yukarıdan aşağı → atom numarası artar.
- En büyük atom numarası: tipik olarak en alt ve en sağ tarafta bulunan elementtir.
-
Dikkat Edilmesi Gereken Seçenekler:
- “Benzer kimyasal özellik, benzer valans elektron sayısı” gibi ifadeler genellikle “aynı grup” demektir.
- “Aynı periyot” sadece katman sayısının aynı olduğunu, kimyasal özelliklerin mutlaka benzer olmayabileceğini gösterir.
-
Şıkların Dikkatli Karşılaştırılması:
- Birden fazla şık benzer cümlelerle sizi yanıltabilir. Örneğin (A) “K ve R benzer özellik gösterir” ile (B) “L ve P valans elektron sayısı eşittir” her ikisi de benzer grupta olma fikrine dayanıyor gibi görünebilir. Ancak tabloya doğru bakıldığında, K ve R’nin aynı sütunda değil aynı satırda (veya farklı sütunlarda) olduğu anlayışı devreye girer.
- (B) şıkkının doğru olduğundan emin olduktan sonra diğerlerinin çürütülmesi bu soruyu çözmekteki en hızlı stratejidir.
Kısa Bir Özet ve Hatırlatma
- Kimyasal özellik benzerliği = Aynı grup
- Valans elektron sayısı = Grup numarası (A grupları için)
- Atom numarasının en büyük olması = Tabloda daha “aşağı” ve “sağ” tarafta bulunmak
- Soruda L ve P aynı dikey sütunu paylaştığından (B) ifadesi geçerli ve doğrudur.
En sık yapılan hatalardan biri, periyodik tabloda “soldan sağa doğru gidildikçe” valans elektron sayısının 1’den 8’e kadar artmasından dolayı bazı öğrencilerin K ve R gibi yanyana (ya da aynı periyotta) bulunan elementlerin benzer özellik göstereceğini düşünmesidir. Aslında tam tersi, benzer özellik gösterenler dikey sütunlarda bulunur.
Genel Değerlendirme
Bu tür sorular, periyodik tablo bilgisinin sağlam temellere oturmasını amaçlar. Doğru tespit yapabilmek için:
- Sütun ve Satır İlişkisi: Harflerle verilen elementlerin sütunda mı yoksa satırda mı hareket ettiği görsel üzerindeki konumlarından anlaşılmaya çalışılır.
- Valans Elektronu: Herhangi iki elementin aynı grupta oldukları söyleniyorsa, kimyasal özellikler benzer, ayrıca son katman elektron sayıları aynıdır.
- Atom Numarası Karşılaştırması: Aynı periyotta soldan sağa doğru, aynı grupta yukarıdan aşağıya doğru atom numarası artar.
(B) ifadesi, bu prensiplerin çok bariz ve net bir uygulamasıdır: Aynı gruptaki L ve P son katmanlarında eşit sayıda elektron taşır. Böylece sorunun doğru cevabı (B) olur.
Sonuç ve Özet
- (A) ve (D) şıklarında bahsedilen “benzer kimyasal özellik” iddiaları, elementlerin grup konumlarına dair sorudaki dizilimle uyuşmaz.
- (C) “R elementinin atom numarasının en büyük olması” ifadesi, genellikle soldan sağa doğru atom numarası arttığından muhtemelen yanlıştır.
- (B) “L ve P’nin son katman elektron sayıları eşittir” ifadesi, her iki elementin aynı sütunda (aynı grupta) yer almasından dolayı doğrudur.
Dolayısıyla aranan yanıt:
(B) L elementi ile P elementinin son katmanında bulunan elektron sayıları eşittir.