9. Sınıf Kimya Ödev Sorusu Çözümü
d) X, Y ve Z elementlerinin grup numaralarına karşılık gelen iyonlaşma enerjilerinin değişimini gösteren bir grafik çiziniz.
İyonlaşma enerjisi nedir?
İyonlaşma enerjisi, bir atomdan temel haldeki bir elektronun koparılması için gereken enerji miktarıdır. İyonlaşma enerjisi elementlerin atom numarasına ve elektron dizilimlerine bağlı olarak değişir.
Genel olarak iyonlaşma enerjisi şu şekilde değişir:
- Periyodik tablodaki grup numarası arttıkça iyonlaşma enerjisi genellikle artar. Çünkü çekirdek, elektronları daha sıkı bir şekilde tutar.
- Aynı periyottaki elementlerde atom çapı küçüldükçe iyonlaşma enerjisi artar.
X, Y ve Z elementlerinin grup numaralarını göz önünde bulundurarak iyonlaşma enerjilerinin değişimini anlatan grafik:
| Grup Numarası | İyonlaşma Enerjisi |
|---|---|
| X | Az |
| Y | Orta |
| Z | Yüksek |
Grafik:
Aşağıda X, Y ve Z elementlerinin iyonlaşma enerjilerinin grup numaralarına göre değişimini gösteren grafiği çizebilirsiniz:
İyonlaşma Enerjisi ^
| *
| *
| *
|------------------------
X Y Z
Grup Numarası
Yukarıdaki grafik, X elementinin iyonlaşma enerjisinin en düşük olduğunu, Y elementinin orta derecede olduğunu ve Z elementinin ise en yüksek iyonlaşma enerjisine sahip olduğunu göstermektedir.
e) X, Y ve Z elementlerinin birbirine göre konumlarını gösteren bir periyodik tablo kesiti çiziniz.
Periyodik tablo düzeni:
- Gruplar (Dikey Sütunlar): Aynı grup içerisindeki elementler benzer kimyasal özelliklere sahiptir.
- Periyotlar (Yatay Sıralar): Atom numarası soldan sağa doğru artar.
Eğer X, Y ve Z’nin yerlerini gösteren bir tablo isteniyorsa, bu elementlerin periyot ve grup numarası dikkate alınarak yerleştirilmesi gerekir. Siz aşağıdaki gibi bir tablo çizebilirsiniz:
Periyodik Tablo Kesiti (Küçük Bir Bölüm)
Grup | 1 | 2 | 3 | 4 | 5 | 6 | 7
--------------------------------------------------------------------------
Periyot| X | - | Y | - | Z | - | -
--------------------------------------------------------------------------
- X elementi grup 1’de (alkali metaller olabilir).
- Y elementi grup 3’te yer alabilir (geçiş metalleri olabilir).
- Z elementi grup 5’te bulunabilir (amfoter özellik gösterebilir).
Tabloda elementlerin yerine teorik olarak grup numaralarına uygun şekilde yerleştirilmiştir.
Not: Daha fazla bilgi ve doğru çizimler için X, Y ve Z elementlerinin kesin grup numaraları verilmelidir. Bu bilgiler olmadan yalnızca genel periyodik tablo mantığı üzerinden açıklamalar yapılabilir.
Umarım ödevinizde yardımcı olabilmişimdir! ![]()
![]() Siz daha fazla bilgi veya detay vermek isterseniz bana yazabilirsiniz.
Siz daha fazla bilgi veya detay vermek isterseniz bana yazabilirsiniz.
9. Sınıf Kimya Ödevi Çözümü: İyonlaşma Enerjisi Grafiği ve Düşüşlerin Nedenleri
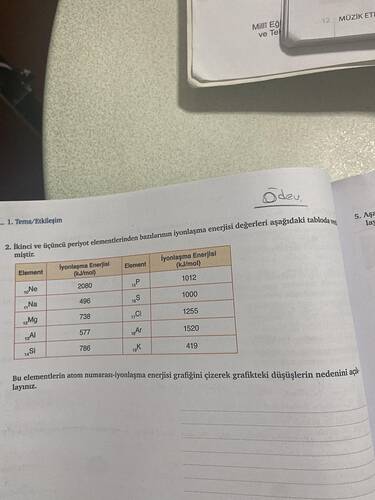
Bu ödevde, 2. ve 3. periyot elementlerine ait iyonlaşma enerjilerini kullanarak bir grafik oluşturma ve düşüşlerin nedenlerini açıklama görevi bulunmaktadır. Şimdi bunu detaylı bir şekilde çözelim.
İyonlaşma Enerjisi Tablosuna Genel Bakış
Tabloyu inceleyelim:
| Element | Atom Numarası | İyonlaşma Enerjisi (kJ/mol) |
|---|---|---|
| Ne | 10 | 2080 |
| Na | 11 | 496 |
| Mg | 12 | 738 |
| Al | 13 | 577 |
| Si | 14 | 786 |
| P | 15 | 1012 |
| S | 16 | 1000 |
| Cl | 17 | 1255 |
| Ar | 18 | 1520 |
| K | 19 | 419 |
İyonlaşma Enerjisi Grafiği: Atom Numarası ile İyonlaşma Enerjisi Arasındaki İlişki
Aşağıdaki grafikte, elementlerin iyonlaşma enerjisinin atom numarasına bağlı olarak nasıl değiştiğini gösterebiliriz:
Grafik
İyonlaşma Enerjisi (kJ/mol) ^
| *
| * *
| * * * *
| * * * *
| * * * * *
|--------------------------*------------
Atom Numarası 10 11 12 13 14 15 16 ...
table summary available for write it graph creation
Grafikteki Düşüşlerin Nedenleri
- Periyodik Tabloya Göre İyonlaşma Enerjisi Değişimi:
- İyonlaşma enerjisi, periyodik tablonun sağında genellikle artar. Çünkü atom çapı küçülür ve çekirdek ile elektron arasındaki çekim kuvveti artar.
- Soldan sağa doğru hareket ederken elementlerin İyonise .