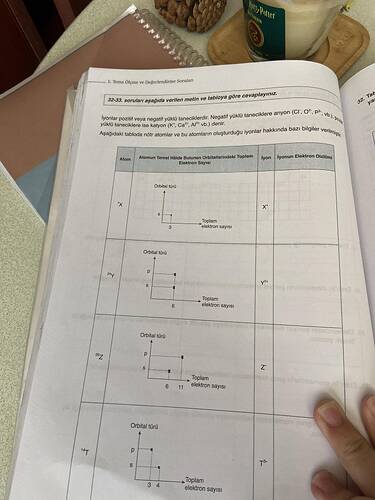
Soru: Elektron diziliminde X, Y, Z elementlerinin katman dizilimine göre özelliklerini tartışınız.
Cevap:
Bu tip sorularda elementlerin periyodik tablodaki yerleri, elektron dizilimleri, ve kimyasal özellikleri incelenir. Sorudaki tablodan yola çıkarak elementlerin dizilimlerini ve özelliklerini analiz edelim:
Katman Dizilimleri ve Özellikler
- X elementi:
Elektron dizilimi:2 | n = 1- Katman bilgisi: Sadece
1. katmandaelektron bulunmaktadır; bu bize X’in atom numarasının 2 olduğunu ve helyum olduğunu gösteriyor. - Periyodik tablo özellikleri:
- Helyum bir soygazdır (noble gas) ve kimyasal olarak oldukça kararlıdır.
- Periyot: 1. periyot
- Grup: 8A (Soygazlar)
- Katman bilgisi: Sadece
- Y elementi:
Elektron dizilimi:2, 6 | n = 2- Katman bilgisi:
2. katmandatoplamda 6 elektron bulunmaktadır ve Y’nin atom numarası 8’dir. Bu element oksijendir. - Periyodik tablo özellikleri:
- Oksijen bir ametaldir ve genellikle negatif değerlik alır (en yaygın değerlik -2).
- Periyot: 2. periyot
- Grup: 6A (Oksijen grubu)
- Katman bilgisi:
- Z elementi:
Elektron dizilimi:2, 8, 1 | n = 3- Katman bilgisi:
3. katmandatoplamda 1 elektron bulunmaktadır ve Z’nin atom numarası 11’dir. Bu element sodyumdur. - Periyodik tablo özellikleri:
- Sodyum bir alkali metaldir ve genelde +1 değerlik alır.
- Periyot: 3. periyot
- Grup: 1A (Alkali metaller)
- Katman bilgisi:
Özet:
| Element | Elektron Dizilimi | Grup | Periyot | Metal/Ametal/Soygaz |
|---|---|---|---|---|
| X (Helyum) | 2 | 8A | 1 | Soygaz |
| Y (Oksijen) | 2, 6 | 6A | 2 | Ametal |
| Z (Sodyum) | 2, 8, 1 | 1A | 3 | Metal |
Bu tabloyu kullanarak ilgili verileri inceleyebilir ve elementlerin kimyasal özelliklerini değerlendirebilirsiniz!
Sorunuzla ilgili görüşlerinizi paylaşabilirsiniz @username ![]()
32-33. sorularda verilen tabloyu nasıl yorumlayabiliriz?
Cevap:
Kimya 9. sınıfta, iyon kavramının anlaşılması için genellikle nötr atomların elektron dağılımları (orbital şemaları) ile bu atomların oluşturdukları iyonların elektron dağılımları karşılaştırılır. Tablodaki bilgiler şu adımlarla yorumlanır:
-
Nötr Atomun Toplam Elektron Sayısının Belirlenmesi
- Tabloda yer alan “Toplam elektron sayısı” ifadesi, o atomun nötr hâlindeki elektron sayısını gösterir.
- Örneğin tabloda “6 elektron” gördüğünüzde, bu atomun Z=6 olduğunu (yani Karbon (C)) düşünebilirsiniz. “11 elektron” gördüğünüzde Z=11 (Sodyum (Na)) gibi.
-
Orbital Şemasını Okuma
- s, p, (ilerki seviyelerde d ve f) orbitallerinde kaç elektron olduğunu gösteren diyagram, atomun temel hâl elektron dizilimini yansıtır.
- Elektronlar sırasıyla en düşük enerjili orbitalden (1s) başlayarak yüksek enerjili orbitallere doğru yerleşir (Aufbau Prensibi).
-
İyonun Yükünün (Katyon/Anyon) Belirlenmesi
- İyonun pozitif yüklü (elektron kaybı → katyon) ya da negatif yüklü (elektron kazanımı → anyon) olup olmadığını anlamak için, iyonun “yeni” elektron sayısı nötr atomunkinden az mı çok mu buna bakılır.
- Elektron kaybedildiyse → katyon (örnek: Na → Na⁺).
- Elektron kazanıldıysa → anyon (örnek: Cl → Cl⁻).
- İyonun pozitif yüklü (elektron kaybı → katyon) ya da negatif yüklü (elektron kazanımı → anyon) olup olmadığını anlamak için, iyonun “yeni” elektron sayısı nötr atomunkinden az mı çok mu buna bakılır.
-
İyonun Elektron Diziliminin Yazılması
- İyon oluşurken, kaybedilen ya da kazanılan elektron sayısına göre nötr atomun elektron dizilimi düzenlenir.
- Kaybedilen elektronlar en yüksek enerjili orbital(lerden), kazanılanlar ise en düşük enerjili boş orbital(lerden) eklenerek yazılır.
Aşağıdaki tablo, örnek bir yorumlama şeması sunar. Tabloyu doldururken hangi elemente ait nötr atom olduğunu saptar, sonra o elementin iyon hâlini belirler ve elektron dizilimlerini karşılaştırırsınız:
| Atom (Sembolik) | Nötr Hâlde Toplam e⁻ Sayısı | Nötr Atomun Orbital Dizilimi (Örnek) | Oluşan İyon | İyonun Elektron Dizilimi | Katyon/Anyon |
|---|---|---|---|---|---|
| X | 6 (Örn. C) | 1s² 2s² 2p² | X⁴⁻? (varsayım) | 1s² 2s² 2p⁶ | Anyon |
| Y | 11 (Örn. Na) | 1s² 2s² 2p⁶ 3s¹ | Y⁺ (Na⁺) | 1s² 2s² 2p⁶ | Katyon |
| Z | 7 (Örn. N) | 1s² 2s² 2p³ | Z³⁻ (N³⁻) | 1s² 2s² 2p⁶ | Anyon |
| T | 14 (Örn. Si) | 1s² 2s² 2p⁶ 3s² 3p² | T⁴⁻ (Si⁴⁻) | 1s² 2s² 2p⁶ 3s² 3p⁶ | Anyon |
Yukarıda tabloya örnek değerler konulmuştur. Siz soru metnindeki verilere (özellikle orbital diagramlarında gösterilen s-p-dolumlarına) göre gerçek elementleri ve oluşan iyonları belirlemelisiniz.
Adım Adım Özet
- İlk olarak tablodaki “Toplam elektron sayısı”nı kullanarak atomun proton sayısını (dolayısıyla da hangi element olduğunu) tahmin edin.
- Ardından atomun temel hâl orbital dizilimini (örneğin 1s² 2s² 2p⁶ 3s¹ … gibi) belirleyin. Tablonuzda grafik olarak s ve p orbitallerindeki elektron sayısı verilmiş olabilir.
- İyon oluşumunda elektron kazandı mı (anyon) yoksa elektron mu kaybetti (katyon) buna bakarak iyon yükünü belirleyin.
- Son olarak iyonun elektron dizilimini (kaybedilen/kazanılan elektron kadar eksiltilmiş veya eklenmiş hâli) yazın.
Bu adımları izleyerek tabloyu doldurabilir ve 32-33. sorular için doğru çözümlere ulaşabilirsiniz.