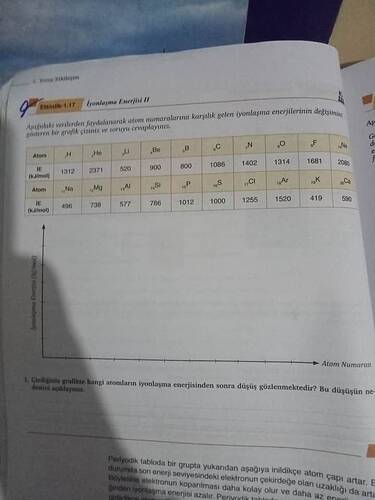
İyonlaşma Enerjisi Grafiği Çizimi ve Analizi
Aşağıdaki tabloda verilen iyonlaşma enerjisi verileri, atom numaralarına karşılık gelmektedir. Bu değerleri kullanarak bir grafik çizebiliriz ve ardından grafikteki belirgin düşüşlerin nedenlerini açıklayabiliriz.
Tablo: İyonlaşma Enerjileri
| Atom | Atom Numarası | IE (kJ/mol) |
|---|---|---|
| H | 1 | 1312 |
| He | 2 | 2371 |
| Li | 3 | 520 |
| Be | 4 | 900 |
| B | 5 | 800 |
| C | 6 | 1086 |
| N | 7 | 1402 |
| O | 8 | 1314 |
| F | 9 | 1681 |
| Ne | 10 | 2080 |
| Na | 11 | 496 |
| Mg | 12 | 738 |
| Al | 13 | 577 |
| Si | 14 | 786 |
| P | 15 | 1012 |
| S | 16 | 1000 |
| Cl | 17 | 1255 |
| Ar | 18 | 1520 |
| K | 19 | 419 |
| Ca | 20 | 590 |
Grafik Çizimi
Buradaki adım, sayısal verileri görselleştirmek için bir çizgi grafiği çizmektir. Grafikte yatay eksende atom numaraları, dikey eksende ise iyonlaşma enerjileri yer alacaktır. Grafik, atom numaraları arttıkça iyonlaşma enerjisindeki değişiklikleri gösterecektir.
Grafikteki Dikkat Çekici Düşüşler
Özellikle dikkat çekici olan iyonlaşma enerjisi düşüşleri şunlardır:
-
Li’den Sonra: Helium’dan Lityum’a geçerken büyük bir düşüş gözlemlenmektedir. Bu düşüş, 2. periyoddan 3. periyotdaki s-orbitaline geçişten kaynaklanmaktadır. 1s’deki elektronların tamamı dolduktan sonra yeni bir elektron 2s orbitaline geçer ve bu, iyonlaşma enerjisinin düşmesine neden olur.
-
Na’den Sonra: Neon’dan Sodyum’a geçerken de benzer bir düşüş gözlemlenir. Bu geçiş, asal gaz olan Ne’den alkali metal olan Na’ya geçişi temsil eder ve elektron konfigürasyonundaki değişiklikler (örneğin, yeni bir kabuk başlaması) nedeniyle iyonlaşma enerjisi azalır.
-
K’dan Sonra: Argon’dan Potasyum’a geçiş sürecinde de önemli bir düşüş görülmektedir. Bu, elektron yapıdaki değişiklikler ve arttırılmış elektron kabuğu sayısı nedeniyle olur.
Düşüş Nedenlerinin Açıklaması
Grafikteki düşüşlerin temel nedeni, elektronların atom çekirdeğinden uzaklaşması ve bu sayede çekim kuvvetinin zayıflamasıdır. Periyodik tablodaki konum değişimleri, yeni elektron kabuklarının devreye girmesi veya asal gazlardan daha reaktif metallere geçiş ile birlikte görülür.
-
Yeni Kabuk Başlama Etkisi: Yeni bir atom kabuğunun başlaması, iç elektronların yeni gelen elektronlara göre daha fazla çekirdek tarafından korunması anlamına gelir. Bu da dışardaki elektronların daha kolay koparılmasına neden olur.
-
Elektron Yapısı ve Dengeleme: Denge değişiklikleri, örneğin dolu bir p-orbitalinden dolmayacak bir s-orbitaline geçiş anlamına gelebilir ve bu da iyonlaşma enerjisinde değişikliklere yol açar.
Bu analiz, iyonlaşma enerji eğilimlerinin ve bu eğilimlerin altında yatan nedenlerin anlaşılmasını sağlar. İyonlaşma enerjisinin genel eğilimi, atom numarası arttıkça artar, ancak belirttiğimiz gibi büyük düşüşler periyodik tablodaki belirli yapısal değişikliklerden kaynaklanır.