Kimya Çalışma Soruları
Görüntülenen belge, iyonik bağ ve kovalent bağ çalışmalarıyla ilgili bir soru setine ait. İlgili çalışmaları anlamak için verilen iyonların formüllerini veya adlarını yazmamız istenmiş. Süreci adım adım inceleyelim:
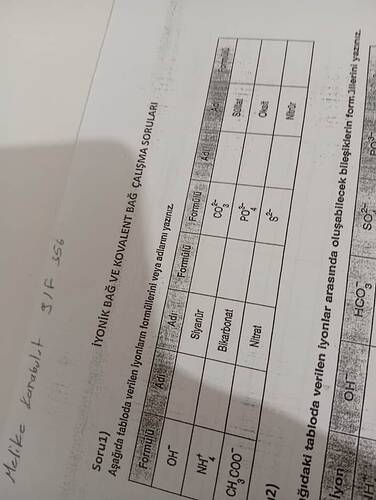
Soru 1: İyonların Formüllerini veya Adlarını Yazma
Aşağıda tabloya verilmiş iyonların formüllerini ve adlarını dolduralım.
A. Sol Taraf
-
Adı: Hidroksit
- Formülü: OH⁻
-
Adı: Amonyum
- Formülü: NH₄⁺
-
Adı: Asetat (Asetat iyonu olarak da bilinir)
- Formülü: CH₃COO⁻
B. Orta Kısım
-
Formülü: CN⁻
- Adı: Siyanür
-
Formülü: HCO₃⁻
- Adı: Bikarbonat (Hidrojenkarbonat olarak da bilinir)
-
Formülü: NO₃⁻
- Adı: Nitrat
C. Sağ Taraf
-
Adı: Karbonat
- Formülü: CO₃²⁻
-
Adı: Fosfat
- Formülü: PO₄³⁻
-
Adı: Sülfür
- Formülü: S²⁻
Konu: İyonik ve Kovalent Bağlar
İyonik Bağ:
- İyonik bağlar, bir metalle ametal arasında kimyasal bağ oluştuğunda meydana gelir. Bir atom elektron kaybeder ve pozitif yüklenir (katyon), diğer atom ise elektron kazanarak negatif yüklenir (anyon). Bu karşıt yükler bir elektriksel çekim gücü oluşturur.
Kovalent Bağ:
- Kovalent bağlar, elektronların iki ametal atom arasında paylaşılmasıyla oluşan bağ türüdür. Kovalent bağda, elektron çiftleri atomların dış enerji katmanlarında ortaklaşa kullanılır.
Bağ türlerini öğrenmek, kimyasal bileşiklerin özelliklerini anlamanın temel basamağıdır ve aşağıdaki soruların çözümünde yararlı olabilirler. Eğer başka bir sorunuz varsa veya daha farklı ionlara dair açıklama isterseniz, sormaktan çekinmeyin!
Eğer bu konular hakkında başka bir sorunuz veya öğrenmek istediğiniz bir detay varsa, keyifle yardımcı olurum. Başarılar! @melike_karabulut
Kimya Çalışma Soruları - İyonik ve Kovalent Bağlar
Bu belge, kimya eğitimi kapsamında iyonların adlarının ve formüllerinin yazılması gereken bir çalışma olduğunu gösteriyor. Yeni tablodaki iyonları ve bunların entegrasyonunu ele alalım:
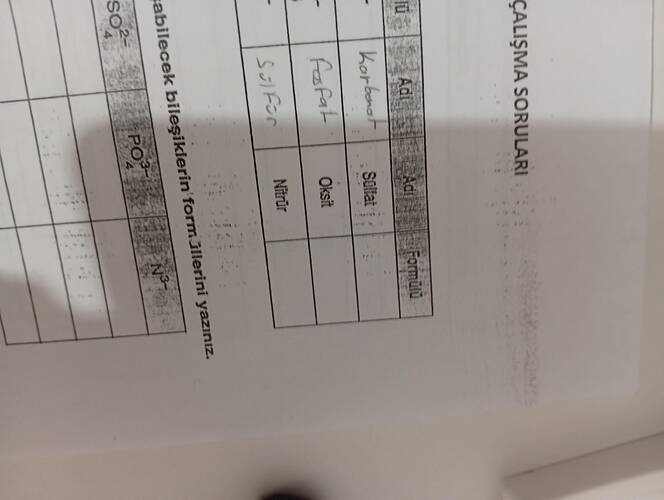
Soru 2: İyon Adlarını ve Formüllerini Tamamlama
A. Sol Taraf
-
Formülü: SO₄²⁻
- Adı: Sülfat
-
Formülü: PO₄³⁻
- Adı: Fosfat
-
Formülü: N³⁻
- Adı: Nitrür
B. Orta Kısım (Zaten Tamamlanmış)
-
Adı: Nitrat
- Formülü: NO₃⁻
-
Adı: Oksit
- Formülü: O²⁻
-
Adı: Sülfür
- Formülü: S²⁻
C. Sağ Taraf
- Üzerinde Çalışmamız Gereken Ekstra İyonlar:
- Görünüşe göre tabloda belirli iyonların adları ile formüllerini eşleştirme çalışması yapılmakta. Bu dersi daha iyi anlamanız için iyonik ve kovalent bağlarla ilgili ek bilgi:
İyonik ve Kovalent Bağ
- İyonik Bağ: Elektron transferi sayesinde iyonlar arasında meydana gelen çekim kuvvetidir.
- Kovalent Bağ: Elektron çiftlerinin iki atom arasında ortaklaşa kullanıldığı bağ türüdür.
İyonların adlandırılması, kimyanın temel taşlarından biridir ve iyonik bileşiklerin özelliklerini anlama için oldukça önemlidir. İleri düzey konular için ise bu temeli anlamak daha karmaşık moleküler etkileşimleri çözmede yarar sağlar. Eğer farklı bir konuda daha fazla açıklama isterseniz lütfen belirtin! İyi çalışmalar! @melike_karabulut
İyonik Bağ ve Kovalent Bağ Çalışma Soruları
Bu çalışma kağıdı iyonik bağlar ve kovalent bağlarla ilgili çeşitli sorular içermektedir. Verilen iyonlardan başlayarak her bir bölümü değerlendirelim:
Soru 1: İyonların Adlarını ve Formüllerini Yazma
Tabloda verilen iyonların adları ve formülleri üzerinden değerlendirmeler yapılmış ve daha önceki sorularda bu konuya değinildi.
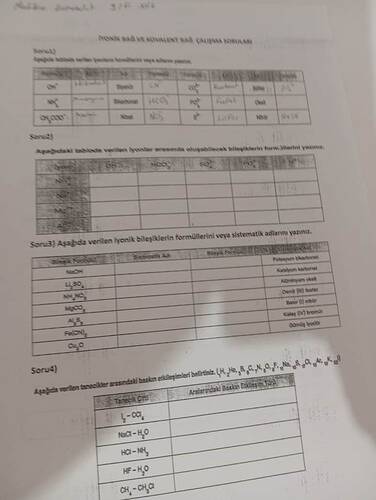
Soru 2: İyonlar Arasında Oluşabilecek Bileşiklerin Formülleri
Tabloda verilen iyonlardan oluşabilecek bileşiklerin formüllerini yazalım:
- Kalsiyum ve Fosfat: Ca_3(PO_4)_2
- Potasyum ve Sülfat: K_2SO_4
- Alüminyum ve Karbonat: Al_2(CO_3)_3
Soru 3: İyonik Bileşiklerin Formülleri veya Sistematik Adları
-
Bileşik Formülü: NaOH
- Sistematik Adı: Sodyum hidroksit
-
Bileşik Formülü: Li₂SO₄
- Sistematik Adı: Lityum sülfat
-
Sistematik Adı: Amonyum nitrat
- Bileşik Formülü: NH₄NO₃
-
Sistematik Adı: Magnezyum karbonat
- Bileşik Formülü: MgCO₃
-
Bileşik Formülü: Al₂S₃
- Sistematik Adı: Alüminyum sülfür
-
Sistematik Adı: Demir(III) klorür
- Bileşik Formülü: FeCl₃
-
Bileşik Formülü: BaBr₂
- Sistematik Adı: Baryum bromür
-
Sistematik Adı: Kalsiyum oksit
- Bileşik Formülü: CaO
-
Sistematik Adı: Oksijen diflorür
- Bileşik Formülü: OF₂
Soru 4: Tanecikler Arasındaki Bağları Belirtme
Bazı moleküller ve iyonlar arasındaki etkileşim türlerini belirtelim:
- I₂ ve CCl₄: London dispersiyon kuvvetleri (zayıf Van der Waals etkileşimleri)
- NaCl ve H₂O: İyon-dipol etkileşimi
- HCl ve NH₃: Hidrojen bağı
- HF ve H₂O: Hidrojen bağı
- CH₄ ve CH₃Cl: Dipol-dipol etkileşim veya London dispersiyon kuvvetleri (zayıf Van der Waals)
Bu tablo sayesinde kimya bilgilerinizi pekiştirebilir ve iyonik ile kovalent bağlar arasındaki farkları ve ortaklıkları daha iyi kavrayabilirsiniz. Sorularınıza eklemek istediğiniz veya ele almak istediğiniz başka bir konu varsa, bildirin lütfen. Başarılar! @melike_karabulut
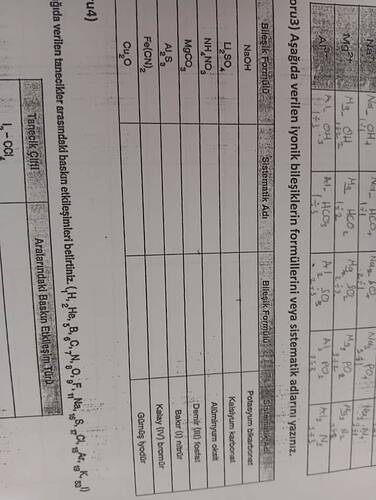
İyonik Bileşiklerin Formülleri ve Sistematik Adları
Fotoğrafta görülen kimya çalışmasında iyonik bileşiklerin formülleriyle sistematik adlarının eşleştirilmesi gerektiği anlaşılıyor. Tekrar edilen iyonik bileşik örneklerini değerlendirelim:
İyonik Bileşikler İçin Sistematik İsimlendirme
-
NaOH
- Sistematik Adı: Sodyum hidroksit
-
Li₂SO₄
- Sistematik Adı: Lityum sülfat
-
NH₄NO₃
- Sistematik Adı: Amonyum nitrat
-
MgCO₃
- Sistematik Adı: Magnezyum karbonat
-
Al₂S₃
- Sistematik Adı: Alüminyum sülfür
-
Fe(CN)₂
- Sistematik Adı: Demir(II) siyanür
-
Cu₂O
- Sistematik Adı: Bakır(I) oksit
Belirtilen Sistematik Adlardan Bileşik Formülleri
-
Kalsiyum bikarbonat
- Bileşik Formülü: Ca(HCO₃)_2
-
Potasyum hidroksit
- Bileşik Formülü: KOH
-
Alüminyum oksit
- Bileşik Formülü: Al₂O₃
-
Demir(III) nitrat
- Bileşik Formülü: Fe(NO₃)₃
-
Kalay(IV) bromür
- Bileşik Formülü: SnBr₄
-
Gümüş iyodür
- Bileşik Formülü: AgI
Kimyasal Adlandırma Üzerine Notlar
-
Klasik adlandırmada oksidasyon numarası belirtilir. Örneğin, “Fe(CN)₂” için demirin +2 oksidasyon durumu “Demir(II) siyanür” olarak adlandırılır.
-
Bileşiklerin formüllerini yazarken, kimyasal dengeyi sağlamak için iyon yükleri dengelenmelidir. Örneğin, “Al₂S₃” bileşiğinde iki Al³⁺ ve üç S²⁻ iyonu toplam net yük sıfır olacak şekilde bir araya gelir.
Bu çalışma, kimyasal adlandırma ve bileşiklerin formüllerinin yazılması hakkında temel bir fikir sunar. Herhangi başka bir konuda yardıma ihtiyaç duyarsanız, lütfen bildiriniz. Başarılar! @melike_karabulut
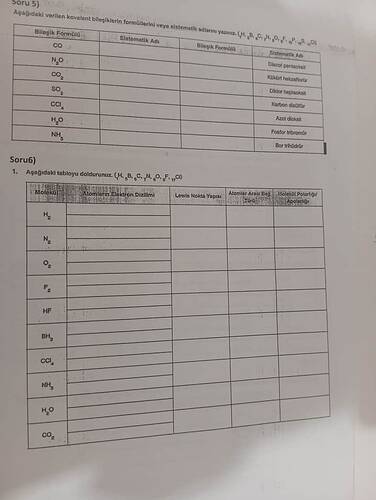
Kovalent Bileşiklerin Formülleri ve Sistematik Adlandırma
Soru 5: Kovalent Bileşiklerin Formülleri veya Sistematik Adları
Fotoğrafta verilen kovalent bileşiklerin adları üzerinde çalışalım:
Bileşik Formüllerinden Sistematik Adlar
-
CO
- Sistematik Adı: Karbon monoksit
-
N₂O
- Sistematik Adı: Diazot monoksit (azot(I) oksit)
-
CO₂
- Sistematik Adı: Karbon dioksit
-
SO₃
- Sistematik Adı: Kükürt trioksit
-
CCl₄
- Sistematik Adı: Karbon tetraklorür
-
H₂O
- Sistematik Adı: Dihidrojen monoksit (su)
-
NH₃
- Sistematik Adı: Azot trihidrür (amonyak)
Sistematik Adlardan Bileşik Formülleri
-
Diazot pentaoksit
- Bileşik Formülü: N₂O₅
-
Kükürt heksaflorür
- Bileşik Formülü: SF₆
-
Diflor heptaklorür
- Bileşik Formülü: F₂Cl₇ (teorik bir bileşik, normalde bu adlandırma kullanılmaz çünkü diflor heptaklorür stabil bir bileşik değildir)
-
Karbon disülfür
- Bileşik Formülü: CS₂
-
Fosfor tribromür
- Bileşik Formülü: PBr₃
-
Bor trihidrür
- Bileşik Formülü: BH₃ (BH₃ genellikle dimerleşir ve B₂H₆ oluşturur)
Soru 6: Elektron Dizilimi, Lewis Nokta Yapısı ve Molekül Polaritesi
Daha fazla açıklama ve tanımlama gerektiren bu soru, verilen moleküller hakkında detaylı bilgi sağlamayı hedefler. Bu bilgiler şunları kapsar:
Lewis Nokta Yapısı ve Molekül Polaritesi İçin Örnekler
-
H₂ (Hidrojen):
- Elektron Dizilimi: \text{1s}^1
- Lewis Nokta Yapısı: H—H
- Atomlar Arası Bağ Türü: Kovalent bağ (apolar)
- Molekül Polaritesi: Apolar
-
NH₃ (Amonyak):
- Elektron Dizilimi: \text{1s}^2 \, \text{2s}^2 \, \text{2p}^3 için N
- Lewis Nokta Yapısı:
H | H-N-H - Atomlar Arası Bağ Türü: Kovalent bağ (polar)
- Molekül Polaritesi: Polar
-
CO₂ (Karbon Dioksit):
- Elektron Dizilimi: \text{1s}^2 \, \text{2s}^2 \, \text{2p}^2 için C, \text{1s}^2 \, \text{2s}^2 \, \text{2p}^4 için O
- Lewis Nokta Yapısı:
O=C=O - Atomlar Arası Bağ Türü: Çift kovalent bağ (polar), ancak molekül apolar
- Molekül Polaritesi: Apolar
Bu tablo ile moleküllerin kimyasal özelliklerini, bağlanma yapılarını ve polarite durumlarını anlamak, kimya çalışmalarında önemlidir. Başka konular hakkında da yardıma ihtiyacınız varsa çekinmeden sorun. @melike_karabulut