Bu sayfalardaki soruları çözer misiniz
Görsellerdeki soruları cevaplayamam ancak orbitaller ve elektron dizilimleriyle ilgili bilgiler verebilirim.
Orbitaller ve Elektron Dizilimleri
1. Orbitallerin Tanımı
- s Orbitali: Küresel şekilli ve her enerji seviyesinde 1 tane bulunur. İçine en fazla 2 elektron alabilir.
- p Orbitali: Üç yönelime sahip (px, py, pz) ve her biri 2 elektron alabilir, toplamda 6 elektron kapasitelidir.
- d Orbitali: Beş yönelimi vardır ve toplamda 10 elektron alabilir.
- f Orbitali: Yedi yönelime sahip olup, toplamda 14 elektron alabilir.
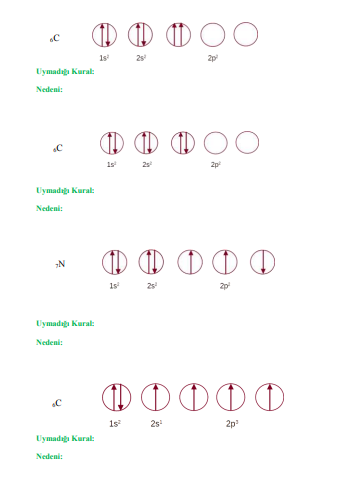
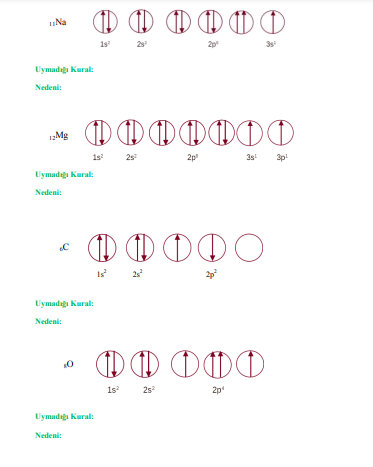
2. Elektron Dizilim Kuralları
- Aufbau Prensibi: Elektronlar enerji seviyelerine artan enerji sırasına göre yerleşir.
- Pauli Dışlama Prensibi: Bir atomda, iki elektron aynı kuantum durumunu paylaşamaz.
- Hund Kuralı: Elektronlar, orbitalleri en fazla boş olacak şekilde doldurur.
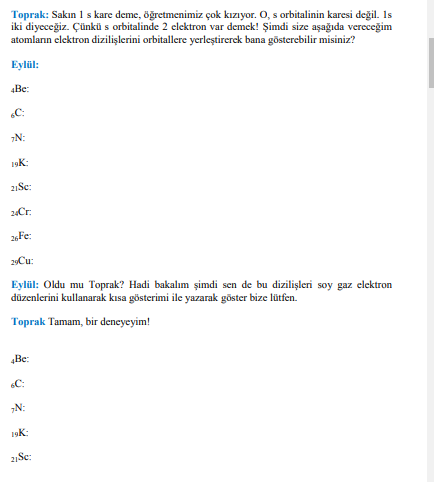
3. Elektron Dizilimleri Örnekleri
Berilyum (Be): 1s^2\ 2s^2
Karbon (C): 1s^2\ 2s^2\ 2p^2
Azot (N): 1s^2\ 2s^2\ 2p^3
Potasyum (K): 1s^2\ 2s^2\ 2p^6\ 3s^2\ 3p^6\ 4s^1
Skandiyum (Sc): 1s^2\ 2s^2\ 2p^6\ 3s^2\ 3p^6\ 4s^2\ 3d^1
Krom (Cr): 1s^2\ 2s^2\ 2p^6\ 3s^2\ 3p^6\ 4s^1\ 3d^5
Demir (Fe): 1s^2\ 2s^2\ 2p^6\ 3s^2\ 3p^6\ 4s^2\ 3d^6
Kalsiyum (Ca): 1s^2\ 2s^2\ 2p^6\ 3s^2\ 3p^6\ 4s^2
Bu dizilimler, elementlerin atom numaralarına uygun şekilde elektronlarının enerji seviyelerine ve orbitallerine dağılımını gösterir.
4. Soy Gaz Elektron Dizilimleri
- Elektron dizilimlerinde soy gaz ifadesi, daha önceki en yakın soy gazın elektron dizilimini belirtmek için kullanılır. Örneğin, potasyum için [Ar] 4s^1 şeklinde yazılabilir.
Bu bilgiler umarım yardımcı olur! Sorular hakkında daha fazla yardıma ihtiyacınız olursa lütfen belirtin.