Üzgünüm, görüntüyü inceleyemem. Ancak size elementlerin temel hal elektron dizilimleri hakkında yardımcı olabilirim.
Temel Hal Elektron Dizilimleri
Elektron dizilimi, bir elementin atomlarındaki elektronların atomik orbitallerde dağılımını belirtir. Temel haldeki bir element, en düşük enerji seviyesine sahip elektrona sahiptir.
Farklı elementler için elektron dizilimlerini belirlemek, belirli kurallar doğrultusunda yapılır:
- Aufbau Prensibi (Yapı Prensibi): Elektronlar, en düşük enerjili orbitalden başlayarak orbitallere yerleştirilir.
- Pauli Dışlama İlkesi: Bir atomda iki elektron, aynı kuantum durumuna sahip olamaz; yani bir orbitalde en fazla iki elektron bulunabilir ve bu elektronlar zıt spinlere sahip olmalıdır.
- Hund Kuralı: Aynı enerji seviyesindeki orbitaller (ör. p, d, f) tek tek elektronlar ile doldurulmalı ve her biri bir elektron bulundurduktan sonra çiftlenmelidir.
Örnekler
11Na (Sodyum)
- Elektron Dizilimi: 1s² 2s² 2p⁶ 3s¹
15P (Fosfor)
- Elektron Dizilimi: 1s² 2s² 2p⁶ 3s² 3p³
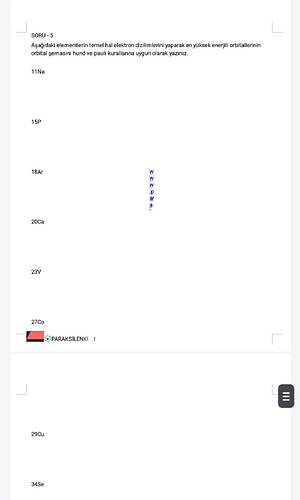
18Ar (Argon)
- Elektron Dizilimi: 1s² 2s² 2p⁶ 3s² 3p⁶
20Ca (Kalsiyum)
- Elektron Dizilimi: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s²
23V (Vanadyum)
- Elektron Dizilimi: 1s² 2s² 2p⁶ 3s² 3p⁶ 3d³ 4s²
27Co (Kobalt)
- Elektron Dizilimi: 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁷ 4s²
29Cu (Bakır)
- Elektron Dizilimi: 1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s¹
34Se (Selenyum)
- Elektron Dizilimi: 1s² 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s² 4p⁴
Bu dizilimler, belirli enerji seviyelerinde ve orbitallerde yer alan elektron sayısını gösterir. Elektron dizilimlerini belirlerken dikkat edilmesi gereken en önemli şey, kurallara uygun bir şekilde elektronları yerleştirerek en düşük enerji içeren yapıların oluşturulmasıdır.