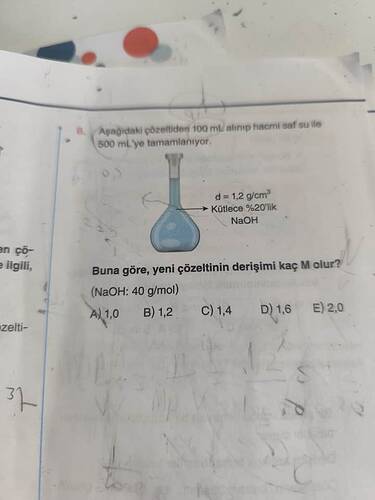Aşağıdaki sorunun çözümünü gerçekleştirmek için adım adım ilerleyelim:
Öncelikle, elimizde verilere bir göz atalım:
- Başlangıçta %20’lik (w/w) NaOH çözeltisi var.
- Çözeltinin yoğunluğu d = 1.2 \, \text{g/cm}^3.
- Çözelti miktarı 100 \, \text{mL} ve bu seyreltildikten sonra toplam 500 \, \text{mL} oluyor.
Adım 1: %20’lik Çözeltinin NaOH Kütlesini Bulma
%20’lik NaOH çözeltisi, kütlesinin %20’sinin NaOH olduğunu belirtir. Yani, 100 gram çözeltide 20 gram NaOH var demektir.
Çözeltinin toplam kütlesi:
- Yoğunluk (d) formülünü kullanarak, kütle (m) hesaplayabiliriz:
$$m = V \times d = 100 , \text{mL} \times 1.2 , \text{g/mL} = 120 , \text{g}$$
NaOH Kütlesi:
- %20’lik bir çözeltide NaOH kütlesi:
$$\text{NaOH kütlesi} = \frac{20}{100} \times 120 , \text{g} = 24 , \text{g}$$
Adım 2: Çözeltinin Seyreltilmesi ve Molaritenin Hesaplanması
Çözeltimizin hacmi 500 \, \text{mL}'ye çıkarıldığında, NaOH miktarı değişmez ancak konsantrasyonu değişecek.
Molariteyi (M) Hesaplama:
-
Molarite formülü: M = \frac{n}{V}; burada n mol sayısı, V ise litre cinsinden hacimdir.
-
n = \frac{\text{NaOH kütlesi}}{\text{NaOH'nin molar kütlesi}} = \frac{24 \, \text{g}}{40 \, \text{g/mol}} = 0.6 \, \text{mol}
-
Hacim 0.5 \, \text{L} (500 mL = 0.5 L).
Molarite:
M = \frac{0.6 \, \text{mol}}{0.5 \, \text{L}} = 1.2 \, \text{M}
Sonuç:
Çözeltinin yeni molaritesi 1.2 M olur. Bu durumda doğru cevap B) 1,2’dir.