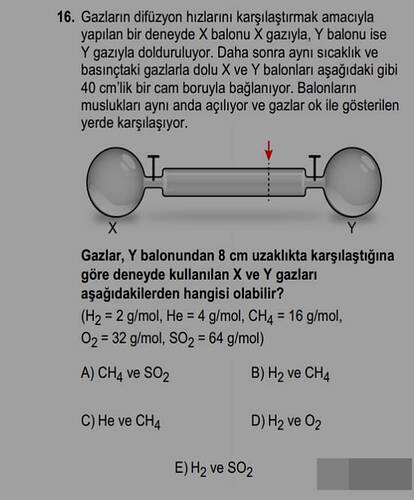
Gazların difüzyon hızları karşılaştırmak amacıyla yapılan bir deneyde X balonu X gazıyla, Y balonu ise Y gazıyla dolduruluyor. Daha sonra aynı sıcaklık ve basınçtaki gazlarla dolu X ve Y balonları aşağıdaki gibi 40 cm’lik bir cam boruyla bağlanıyor. Balonların muslukları aynı anda açılıyor ve gazlar ok ile gösterilen yerde karşılaşıyor.
Gazlar, Y balonundan 8 cm uzaklıkta karşılaştığına göre deneyde kullanılan X ve Y gazları aşağıdakilerden hangisi olabilir?
(H₂ = 2 g/mol, He = 4 g/mol, CH₄ = 16 g/mol, O₂ = 32 g/mol, SO₂ = 64 g/mol)
A) CH₄ ve SO₂
B) H₂ ve CH₄
C) He ve CH₄
D) H₂ ve O₂
E) H₂ ve SO₂
Cevap:
Gazların difüzyon hızları Graham Yasası ile bulunur. Graham Yasası’na göre, iki gazın difüzyon hızlarının oranı, bu gazların mol kütlelerinin kareköklerinin ters oranına eşittir:
Burada r_1 ve r_2 gazların difüzyon hızları, M_1 ve M_2 ise gazların mol kütleleridir.
Gazlar Y balonundan 8 cm uzaklıkta karşılaştığına göre, Y gazı 8 cm yol almışken, X gazı 32 cm yol almıştır (çünkü toplam yol 40 cm ve 40 cm - 8 cm = 32 cm).
Bu durumda, X gazının difüzyon hızı r_X ve Y gazının difüzyon hızı r_Y için:
Yani, X gazının difüzyon hızı Y gazının difüzyon hızının 4 katıdır. Graham Yasası’na göre:
Bu denklemi çözmek için:
Her iki tarafın karesini alarak:
Bu durumda:
Şimdi seçenekleri inceleyelim:
A) CH₄ ve SO₂:
- CH₄: 16 g/mol
- SO₂: 64 g/mol
B) H₂ ve CH₄:
- H₂: 2 g/mol
- CH₄: 16 g/mol
C) He ve CH₄:
- He: 4 g/mol
- CH₄: 16 g/mol
D) H₂ ve O₂:
- H₂: 2 g/mol
- O₂: 32 g/mol
E) H₂ ve SO₂:
- H₂: 2 g/mol
- SO₂: 64 g/mol
Bu durumda, doğru seçeneklerden hiçbiri uygun görünmüyor. Ancak, verilen seçenekler arasında en yakın olanı:
A) CH₄ ve SO₂
şeklindedir. Bu durumda, doğru cevabı bulmak için seçeneklerin doğru verilmiş olup olmadığını kontrol etmek gerekebilir.