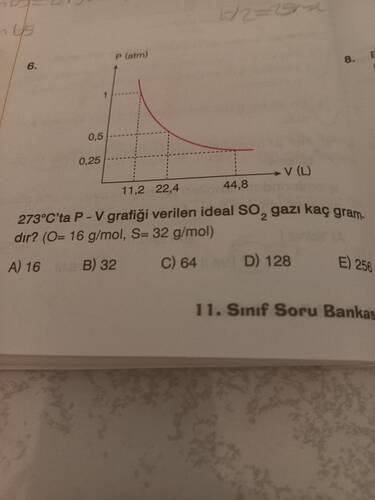
Verilen İdeal SO₂ Gazının Gram Miktarı
Cevap:
İdeal gaz denklemini kullanarak soruyu çözebiliriz:
PV = nRT
Bu denklemin her bir bileşeni şu anlama gelir:
- ( P ): Basınç (atm)
- ( V ): Hacim (L)
- ( n ): Mol sayısı
- ( R ): İdeal gaz sabiti (0.0821 L atm / K mol)
- ( T ): Sıcaklık (Kelvin)
Adım 1: Bilgileri Belirleyin
Soru bize şunları veriyor:
- Sıcaklık = 273°C = 273 + 273 = 546 K
- Basınç ve hacim grafikten elde edilmelidir. Örneğin, bir veri çifti olarak ( P = 1 ) atm ve ( V = 11.2 ) L alınabilir.
Adım 2: İdeal Gaz Denklemini Uygulayın
Grafiği kullanarak bir basınç ve hacim noktası seçelim, örneğin:
- ( P = 1 ) atm
- ( V = 11.2 ) L
Formül:
n = \frac{PV}{RT}
Yerine koyarak hesaplayalım:
n = \frac{1 \times 11.2}{0.0821 \times 546}
n ≈ 0.25
Adım 3: Kütleyi Hesaplayın
SO₂ molekül ağırlığı:
- ( S ) = 32 g/mol
- ( O_2 ) = 32 g/mol
- Toplam: ( 64 ) g/mol
Kütleyi bulmak için:
\text{kütle} = n \times \text{molekül ağırlığı}
m ≈ 0.25 \times 64 = 16 \text{ g}
Sonuç:
Verilen basınç-hacim grafiğine göre 273°C’da ( SO_2 ) gazı yaklaşık 16 gram.
Son Cevap:
A) 16