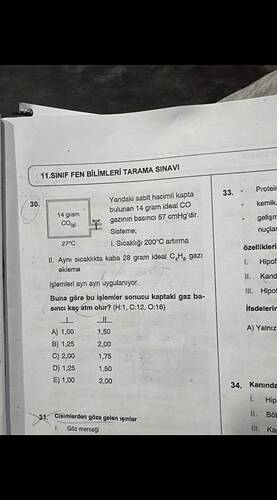
Bu soruda, verilen koşullarda kabın içindeki gazın basıncını bulmamız isteniyor.
Madde 1: İdeal Gaz Kanunu ve Basınç Hesaplama
İdeal gazlar için ( PV = nRT ) formülü kullanılır. Burada:
- ( P ) basınç,
- ( V ) hacim,
- ( n ) mol sayısı,
- ( R ) gaz sabiti,
- ( T ) sıcaklıktır.
Aşama 1: İlk Durum (CO Gazı)
- 14 gram CO gazı var.
- CO’nun mol kütlesi: ( C+O = 12+16 = 28 , \text{g/mol} ).
- Mol sayısı: ( n = \frac{\text{14 g}}{\text{28 g/mol}} = 0.5 , \text{mol} ).
Sıcaklık Artışı Etkisi (İlk Durum)
- Başlangıç sıcaklığı 27°C = 300K (yaklaşık).
- Sıcaklık 200°C artırılırsa, yeni sıcaklık 227°C = 500K olur.
- Basınç artışı ( \frac{T_2}{T_1} ) oranında olur:
- ( \frac{500}{300} = \frac{5}{3} ).
Aşama 2: İkinci Durum (C₄H₈ Eklenmesi)
- 28 gram C₄H₈ ekleniyor.
- C₄H₈’nin mol kütlesi: ( 4 \times 12 + 8 \times 1 = 56 , \text{g/mol} ).
- Mol sayısı: ( n = \frac{\text{28 g}}{\text{56 g/mol}} = 0.5 , \text{mol} ).
Toplam Mol Sayısı ve Basınç
- Toplam mol sayısı = 0.5 (CO) + 0.5 (C₄H₈) = 1 mol.
- Yeni basınç, toplam mol sayısına bağlı olarak artacaktır.
Sonuç Basıncın Hesaplanması
-
İlk Durum:
- Başlangıç basıncı 57 cmHg.
- Sıcaklık arttığında: ( P_1 = 57 \times \frac{5}{3} = 95 , \text{cmHg} ).
-
İkinci Durum:
- Basınç artışı, mol sayısının iki katına çıkması ile ilintilidir:
- Son basınç: ( P_2 = 95 \times 2 = 190 , \text{cmHg} ).
1 atm = 76 cmHg olduğuna göre:
- ( \frac{190}{76} \approx 2.5 , \text{atm} ).
Seçenekler arasında verilen değerlere göre en yakın basıncı hesaplayabiliriz, seçeneklerde hata olabilir ya da bir basamak yuvarlama yapılmış olabilir. Ancak basınç değerinin yaklaşık olarak hesaplamaya yakın olması beklenir.