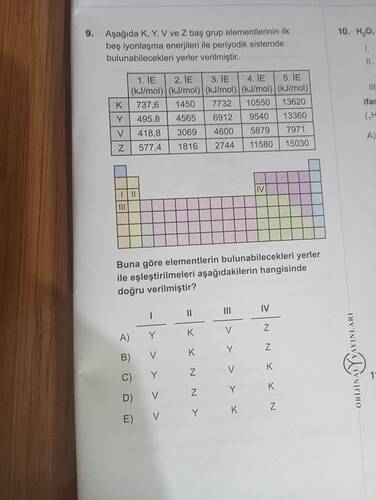
Aşağıdaki K, Y, V ve Z baş grup elementlerinin periyodik sistemdeki konumları ile ilgili soru.
Cevap:
Bu soru, elementlerin iyonlaşma enerjileri göz önünde bulundurularak periyodik sistemdeki yerlerinin belirlenmesini gerektiriyor. İyonlaşma enerjisi, bir atomdan bir elektron koparmak için gereken enerji miktarıdır ve belirli bir düzenlidir: genellikle, daha küçük iyonlaşma enerjileri ile başlar ve genelde atom numarası arttıkça artar.
Adım 1: İyonlaşma Enerjilerini İnceleme
Verilen tabloya bakalım:
- K: 1. IE = 737.6 kJ/mol
- Y: 1. IE = 495.8 kJ/mol
- V: 1. IE = 418.8 kJ/mol
- Z: 1. IE = 577.4 kJ/mol
Adım 2: Periyodik Tablodaki Konumları Belirleme
-
V’nin Konumu: V elementi, en düşük birinci iyonlaşma enerjisine sahiptir. Genellikle, bu tür elemetler alkali metaller grubuna yerleştirilir çünkü bu elementler çok kolay elektron verir ve birinci iyonlaşma enerjileri düşüktür. Bu durumda, V elementi I. grupta yer alabilir.
-
Y’nin Konumu: Y elementi, V elementinden sonra gelen düşük iyonlaşma enerjisi değerine sahip. Yine, nispeten düşük bir iyonlaşma enerjisi sunan bu element alkali toprak metaller grubuna (II. grup) yerleştirilebilir.
-
Z’nin Konumu: Z’nin iyonlaşma enerjisi, diğerlerinden daha yüksektir ki bu da V ve Y’ye kıyasla daha fazla elektron alma eğiliminde olabileceğini gösterir. Bu, grubu IV olabilir.
-
K’nin Konumu: K elementi ise en yüksek birinci iyonlaşma enerjisine sahiptir. Bu durum, K’nin bir soy gaz gibi çok kararlı olduğunu ve bu nedenle IV. grubun elementi olabileceğini gösterir.
Adım 3: Doğru Eşleştirmeyi Belirleme
Yukarıdaki değerlendirmeler sonucunda seçim tablosuna bakıldığında:
- I. grup: V
- II. grup: Y
- III. grup: K
- IV. grup: Z
Bu elementlerin eşleştirilmesi C seçeneğinde verilmiştir.
Sonuç:
C seçeneği doğru cevaptır.