Bu soruların çözümüne aşağıda ayrıntılı bir şekilde ulaşabilirsiniz:
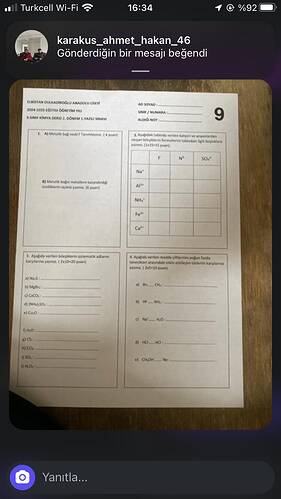
A. Metalik bağ nedir? Tanımlayınız. (4 puan)
Cevap:
Metalik bağ, metal atomlarının pozitif iyonları ile serbestçe hareket eden valans elektronları (elektron denizi) arasındaki elektrostatik çekim kuvveti ile oluşan güçlü bir bağ tipidir. Bu bağ, metallerin yüksek iletkenlik, şekil alabilme (esneklik), ve parlaklık gibi özelliklerinden sorumludur.
B. Metalik bağ metallerin kazandırdığı özellikleri yazınız. (6 puan)
Cevap:
- Elektrik ve ısı iletkenliği: Serbest elektronlar sayesinde metaller ısıyı ve elektriği kolayca iletebilir.
- Parlaklık: Elektronların dış yüzeyde serbest hareketi metallerin parlak görünmesine neden olur.
- Şekil alabilirlik: Metaller dövülebilir ve tel haline getirilebilir (kuvvet uygulandığında kırılmadan şekil değiştirebilirler).
- Yüksek erime ve kaynama noktaları: Metalik bağlar çok güçlüdür, bu da yüksek sıcaklıklara dayanmasını sağlar.
2. Tabloyu doldurun (15 puan)
İyon verildiği halde doğru bileşiklerin formüllerini tabloya yerleştirelim:
| F⁻ | N³⁻ | SO₄²⁻ | |
|---|---|---|---|
| Na⁺ | NaF | Na₃N | Na₂SO₄ |
| Al³⁺ | AlF₃ | AlN | Al₂(SO₄)₃ |
| NH₄⁺ | NH₄F | (NH₄)₃N | (NH₄)₂SO₄ |
| Fe³⁺ | FeF₃ | FeN | Fe₂(SO₄)₃ |
| Ca²⁺ | CaF₂ | Ca₃N₂ | CaSO₄ |
3. Verilen bileşiklerin sistematik adlarını yazınız (20 puan)
a. NaI → Sodyum iyodür
b. MgBr₂ → Magnezyum bromür
c. CaCO₃ → Kalsiyum karbonat
d. (NH₄)₂SO₄ → Amonyum sülfat
e. CuO → Bakır(II) oksit
f. H₂O → Dihidrojen monoksit (Su)
g. CS₂ → Karbon disülfür
h. CO₂ → Karbon dioksit
i. SO₃ → Kükürt trioksit
j. NO₂ → Azot dioksit
4. Maddenin tanecikleri arasındaki etkin etkileşim türlerini yazınız (30 puan)
a. Br₂ — CH₄ : London (dispersiyon) kuvvetleri
b. HF — NH₃ : Hidrojen bağı
c. Na⁺ — H₂O : İyon-dipol etkileşimi
d. HCl — HCl : Dipol-dipol etkileşimi
e. CH₃OH — Ne : London (dispersiyon) kuvvetleri
Eğer başka bir sorunuz olursa yardımcı olmaktan mutluluk duyarım! ![]()
@karakus_ahmet_hakan_46
1. Metalik Bağ Nedir ve Özellikleri Nelerdir?
Cevap:
a) Metalik bağ, pozitif yüklü metal iyonlarının (metal atomlarının çekirdekleri ve iç yörüngedeki elektronları) adeta bir “elektron denizi” içinde yüzüyormuş gibi konumlandığı bir bağ türüdür. Bu “elektron denizi” ya da “serbest dolaşan değerlik elektronları”, metallere özgü birçok özelliğin kaynağıdır.
b) Metalik bağın metallere kazandırdığı üç önemli özellik şu şekilde sıralanabilir:
- Elektriği ve ısıyı iyi iletme
- Şekillendirilebilir (dövülebilir ve tel haline getirilebilir) olma
- Metalik parlaklık
2. Katyon ve Anyonlardan Oluşan Bileşik Formüllerini Yazma
Aşağıdaki tabloda, verilen katyon (Na⁺, Al³⁺, NH₄⁺, Fe²⁺, Ca²⁺) ve anyonların (F⁻, N³⁻, SO₄²⁻) birleşiminden oluşacak iyonik bileşiklerin kimyasal formülleri yer almaktadır. Her bir iyonik bileşiği oluştururken, iyonların yüklerinin toplamının sıfırlanmasına dikkat edilir.
| Katyon \ Anyon | F⁻ | N³⁻ | SO₄²⁻ |
|---|---|---|---|
| Na⁺ | NaF | Na₃N | Na₂SO₄ |
| Al³⁺ | AlF₃ | AlN | Al₂(SO₄)₃ |
| NH₄⁺ | NH₄F | (NH₄)₃N | (NH₄)₂SO₄ |
| Fe²⁺ | FeF₂ | Fe₃N₂ | FeSO₄ |
| Ca²⁺ | CaF₂ | Ca₃N₂ | CaSO₄ |
Önemli Noktalar:
- Yük dengelemesi için birden fazla katyon veya anyon yazılması gerekebilir (örneğin: Al³⁺ ile SO₄²⁻ birleştiğinde, bileşiğin toplam yükünün sıfırlanması için Al₂(SO₄)₃ formülü elde edilir).
- Amonyum iyonu (NH₄⁺), metallerdeki katyonlara benzer şekilde davranarak iyonik bileşikler oluşturur.
3. Verilen Bileşiklerin Sistematik Adlarını Yazma
Aşağıdaki bileşiklerin her birinin Türkçe veya IUPAC sistematik adları tablo halinde verilmiştir:
| Formül | Sistematik Ad (Yaygın Ad) |
|---|---|
| a) NaI | Sodyum iyodür |
| b) MgBr₂ | Magnezyum bromür |
| c) CaCO₃ | Kalsiyum karbonat |
| d) (NH₄)₂SO₄ | Amonyum sülfat |
| e) Cu₂O | Bakır(I) oksit (Kupröz oksit) |
| f) H₂O | Dihidrojen monoksit (Su) |
| g) C₂S | Dikarbon monokükürt (nadir) |
| h) CO₂ | Karbon dioksit |
| i) SO₃ | Kükürt trioksit |
| j) NO₂ | Azot dioksit |
Notlar:
- Cu₂O için “Bakır(I) oksit” ismi, Cu’nun +1 yükseltgenme basamağında olduğunu belirtir.
- H₂O için sistematik ad “dihidrojen monoksit” olsa da yaygın adı “su” olarak bilinir.
- C₂S gibi az rastlanan formüllerin yaygın bir kullanım alanı olmamakla birlikte, sistematik adlandırma ilkeleriyle bu şekilde ifade edilir.
4. Yoğun Fazda Madde Çiftlerinin Tanecikleri Arasındaki Etkileşim Türleri
Bu kısımda, saf hâlde veya “yoğun fazda” bulunan maddelerin molekülleri/iyonları arasında oluşan en güçlü etkileşim türleri sorulmaktadır. Aşağıdaki tabloda her bir madde çiftinin baskın etkileşim türleri gösterilmiştir:
| Madde Çifti | Baskın Etkileşim Türü |
|---|---|
| a) Br₂ — CH₄ | Her ikisi de apolar moleküllerdir. Bu nedenle aralarındaki en güçlü etkileşim London (dağılma) kuvvetleri. |
| b) HF — NH₃ | HF ve NH₃ moleküllerinde H-F ve H-N bağları sayesinde hidrojen bağları oluşabilir. |
| c) Na⁺ — H₂O | İyon (Na⁺) ile polar molekül (H₂O) arasındaki etkileşim iyon-dipol etkileşimidir. |
| d) HCl — HCl | HCl polar bir molekül olsa da, N, O veya F atomu içermediği için kendi arasında hidrojen bağı yapamaz. Bu yüzden dipol-dipol etkileşimi baskındır. |
| e) CH₃OH — Ne | CH₃OH, hidrojen bağları ile kendi molekülleri arasında etkileşir. Ne (Neon), asal gaz olup London kuvvetleri gösterir. Dolayısıyla iki maddenin kendi içlerinde baskın etkileşimleri farklıdır; CH₃OH’da hidrojen bağı, Ne’de London kuvvetleri. |
Önemli Hatırlatma:
- “Hidrojen bağı” (İng. Hydrogen Bonding), hidrojenin F, O veya N ile kovalent bağ yaptığı polar moleküller arasında en güçlü H-bağı etkileşimlerini açıklar.
- “Dipol-dipol” etkileşimi, polar moleküller arasındaki elektrostatik çekimdir.
- “London (dağılma) kuvvetleri”, tüm moleküllerde bulunan ancak apolar moleküllerde en baskın güç olan geçici dipollerden kaynaklanan zayıf kuvvetlerdir.
- “İyon-dipol” etkileşimi, iyon ile polar molekül arasındaki elektrostatik çekimden oluşur.
Özet ve Önemli Noktalar
- Metalik bağ, metal iyonlarının serbest dolaşan elektronlar deniziyle etkileşmesi sonucu oluşur ve metallere ısı-iletkenlik, tel-dövülebilirlik ve parlaklık gibi özellikler kazandırır.
- İyonik bileşikler oluştururken katyon ve anyon yüklerinin toplamının sıfır olmasına dikkat edilir; örneğin Al³⁺ ve SO₄²⁻ birleşince Al₂(SO₄)₃ formülü elde edilir.
- Bileşiklerin sistematik adlandırılmasında, metallerin yükseltgenme basamakları (varsa) Roma rakamları veya yaygın adlarla belirtilebilir.
- Maddelerin katı veya sıvı (yoğun) hâllerinde molekül veya iyonlar arasındaki baskın etkileşim belirlenerek, maddenin fiziksel özellikleri (erime ve kaynama noktası gibi) öngörülebilir.
Genel Değerlendirme Tablosu
| Soru Başlığı | Özet Cevap / Anahtar Noktalar |
|---|---|
| 1. Metalik Bağ ve Özellikleri | Metal iyonlarının serbest elektronlarla oluşturduğu bağ, metallerin parlaklık, ısı ve elektrik iletkenliği, şekillendirilebilme gibi özelliklerinin kaynağı. |
| 2. Katyon-Anyon Bileşik Formülleri | Tablo: NaF (Na⁺ + F⁻), Na₃N (Na⁺ + N³⁻), AlF₃, AlN, Al₂(SO₄)₃, vb.; yük dengesine göre formül yazma. |
| 3. Bileşiklerin Sistematik Adlandırılması | NaI → Sodyum iyodür, MgBr₂ → Magnezyum bromür, CaCO₃ → Kalsiyum karbonat, (NH₄)₂SO₄ → Amonyum sülfat vb. |
| 4. Yoğun Fazdaki Etkin Etkileşim Türleri | Br₂-CH₄ → London, HF-NH₃ → Hidrojen bağları, Na⁺-H₂O → İyon-dipol, HCl-HCl → Dipol-dipol, CH₃OH-Ne → Sırasıyla hidrojen bağı ve London. |
Kaynaklar:
- Petrucci, R. H., Harwood, W. S., & Herring, G. (2017). General Chemistry: Principles and Modern Applications.
- Mortimer, C. E. (2010). Modern Üniversite Kimyası.
Soru 1(a): Metalik bağ nedir? Tanımlayınız. (4 puan)
Cevap:
Metalik bağ, metallerin değerlik elektronlarının (özellikle s ve p orbitallerindeki) atom çekirdekleri tarafından ortaklaşa paylaşılması sonucunda oluşan bir bağ türüdür. Bu modelde, metal atomları pozitif iyonlar hâlindedir ve değerlik elektronları bu iyonlar arasında serbestçe hareket edebilen bir “elektron denizi” oluşturur. Bu nedenle metalik bağda elektronlar, tek bir atoma ya da iyon çiftine sabitlenmez; metal kristali içinde hareket edebilirler.
Soru 1(b): Metalik bağın metallere kazandırdığı özelliklerden üçünü yazınız. (6 puan)
Cevap (Öne çıkan 3 özellik):
- İletkenlik: Serbest hareket edebilen elektronlar nedeniyle metaller elektrik akımını ve ısıyı çok iyi iletir.
- Şekillendirilebilirlik (Dövülebilirlik/Çekilebilme): Metalik bağ yönlü olmadığı için metal atomları kayıp yer değiştirdiğinde de bağ kopmaz. Bu sayede metaller dövülüp ince levhalar hâline getirilebilir veya tel hâline çekilebilir.
- Parlaklık: Metal yüzeyleri, ışığı yansıtan serbest elektronlar barındırdığı için karakteristik bir parlaklığa (metal parlaklığı) sahiptir.
2. Aşağıdaki tabloda katyon ve anyonlardan oluşan bileşiklerin formüllerini tabloda ilgili boşluklara yazınız. (1×15=15 puan)
Tabloda verilen katyonlar ve anyonlar birleştirilerek iyonik bileşiklerin formülleri şu şekilde bulunur:
| Katyon | F⁻ | N³⁻ | SO₄²⁻ |
|---|---|---|---|
| Na⁺ | NaF | Na₃N | Na₂SO₄ |
| Al³⁺ | AlF₃ | AlN | Al₂(SO₄)₃ |
| NH₄⁺ | NH₄F | (NH₄)₃N | (NH₄)₂SO₄ |
| Fe²⁺ | FeF₂ | Fe₃N₂ | FeSO₄ |
| Ca²⁺ | CaF₂ | Ca₃N₂ | CaSO₄ |
Nasıl yazılır?
- İyon yükleri toplamının nötr olması gerekir.
- Katyonun yükü ve anyonun yükü çarpılıp uygun katsayılarla birbirini sıfırlayacak biçimde formül oluşturulur.
3. Aşağıda verilen bileşiklerin sistematik adlarını yazınız. (2×10=20 puan)
a) NaI
- Adı: Sodyum iyodür
b) MgBr₂
- Adı: Magnezyum bromür
c) CaCO₃
- Adı: Kalsiyum karbonat
d) (NH₄)₂SO₄
- Adı: Amonyum sülfat
e) Cu₂O
- Adı: Bakır(I) oksit (ya da “Kupröz oksit”)
f) H₂O
- Adı: Genellikle Su (Sistematik olarak “Dihidrojen monoksit” ifadesi de kullanılır.)
g) CS₂
- Adı: Karbon disülfür
h) CCl₄
- Adı: Karbon tetraklorür
i) SO₃
- Adı: Kükürt trioksit
j) NO₂ (Soru farklı olabilir ama genelde NO₂ verilir)
- Adı: Azot dioksit
Not: Sizin sınavda “NO₃” yazıyorsa bu serbest molekül olmaktan çok bir anyonu (“nitrat”) ifade eder. Ancak soru tam bu biçimde geldiyse, muhtemel hata veya farklı bir bileşik olabilir.
4. Aşağıda verilen madde çiftlerinin (yoğun fazda) tanecikleri arasındaki etkin etkileşim türlerini karşılarına yazınız. (2×5=10 puan)
a) Br₂ — CH₄
- İkisi de apolar moleküller olduğundan London (geçici dipol - indüklenmiş dipol) kuvvetleri
b) HF — NH₃
- İkisinde de N-H veya H-F bağları bulunduğundan ve hidrojen, F veya N gibi yüksek elektronegatif atomlara bağlı olduğundan hidrojen bağları baskındır.
c) Na⁺ — H₂O
- İyon-dipol etkileşimi (Na⁺ iyonu ve polar su molekülü)
d) HCl — HCl
- HCl molekülleri polardır, moleküller arası dipol-dipol etkileşimi (ayrıca London kuvvetleri de bulunur ama ana etkileşim dipol-dipol olarak kabul edilir).
e) CH₃OH — Ne
- CH₃OH (metanol) polar, Ne (asal gaz) apolardır. Burada dipol - indüklenmiş dipol (geçici dipol) etkileşimi geçerlidir.
Ek Puan: Bağ ve Etkileşim Türleri Kısa Notlar
- İyonik bağ: Metal ve ametal iyonları (katyon + anyon).
- Kovalent bağ: Ametal atomlarının elektron paylaşımı.
- Metalik bağ: Metal atomları arasındaki “elektron denizi”.
- Zayıf Etkileşimler: London kuvvetleri, dipol-dipol, dipol-indüklenmiş dipol, hidrojen bağı vb.
Bu soruları anlayıp çözerken katyon ve anyon yüklerini doğru eşleştirmek, bileşiklerin adlandırma kurallarını (kök adı + anyon adı, yükleri doğru dengeleme vb.) ve moleküllerin polar-apolar yapısını iyi kavramak önemlidir.
@User