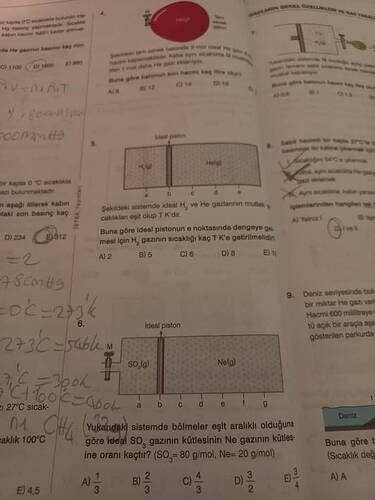
Belirttiğiniz sayfa bir test kitabına ait ve gaz yasaları ile ilgili soruları içeriyor gibi görünüyor. Resimdeki sorular ideal gaz kanunları ve basınç, hacim, sıcaklık gibi değişkenlerle ilgili görünüyor. Özellikle pistonlu sistemleri ve gazların bu sistemlerdeki davranışlarını anlamak için verilen bazı problemler var.
Soruları Açıklama
-
Dördüncü Soru:
- Bu soru bir kapta 3 mol ideal bir gazın hacim değişikliklerini içeriyor.
- Soruda verilen bilgilere göre, gaz molelerinin hacmi soruluyor.
-
Beşinci Soru:
- İdeal H2 ve He gazlarının bir pistonda dengelenmesi isteniyor.
- Soruda H2 gazının dengeli hale gelebilmesi için sıcaklığının ne kadar olması gerektiğini bulmamız isteniyor.
-
Altıncı Soru:
- SO3 ve Ne gazlarının olduğu bir pistonda, iki gazın kütle oranları soruluyor.
- İdeal gazların pistonlarda dengelenmesi ve kütle oranlarının karşılaştırılması amaçlanıyor.
Çözüm Yöntemleri
Bu tür problemlerde genellikle ideal gaz yasasından faydalanabilirsiniz:
İdeal Gaz Yasası
- P: Basınç
- V: Hacim
- n: Mol sayısı
- R: İdeal gaz sabiti
- T: Sıcaklık (Kelvin cinsinden)
Sorulara Nasıl Yaklaşılır?
-
Dördüncü Soruda, gazın basıncı ve hacimleri bilgileriyle ideal gaz kanunu kullanılarak bulunabilir.
-
Beşinci Soruda, denge durumu ve gazların basınçlarının eşitlenmesi için gerekli sıcaklık değişiklikleri hesaplanabilir.
-
Altıncı Soruda, gazların kütle oranlarını bulmak için ilgili kütle ve mol kütlesi değerleri kullanılır.
Bu soruların çözümü için ideal gaz kanunu bilinmesi ve doğru uygulama yapılması gerekir. Bu yüzden, her bir değişkeni dikkatlice inceleyerek işlemleri gerçekleştirmeniz önemlidir.
Niye sorulari cozmuyorsun
Soruları çözebilirim. Lütfen hangi sorunun çözümünü istediğinizi belirtin, her bir soruyu adım adım ele alalım.
4 5 6 soru
4, 5 ve 6. Soruların Çözümü
4. Soru
Soru:
3 mol ideal gaz, hacmi eşit olan 3 farklı bölmeye konulmuş. Katı cisim bu sistemde hacmi değiştirdiğine göre son durumda hangi bölümün hacmi kaç litre olur?
Çözüm:
- Toplam Mol Sayısı: Toplam 3 mol gaz var.
- Hacim Paylaşımı: Başta gazlar eşit hacimlere bölünmüş, dolayısıyla her bölmedeki başlangıç mol sayısı:
- Her bir bölmede: 1 mol gaz.
- İç Basınç Değişimi: Hacim değiştiğinde toplam sistemin basıncı sabitse (kapalı ve izole bir sistemse), her bölmenin hacmi, içindeki mol sayısıyla ters orantılı olarak değişir.
Sonuç: Hangi bölümde hacim değişimi hesaba katılmadığını bilmeden kesin bir cevap verilemez.
5. Soru
Soru:
Bir pistonda H2 ve He gazları var. Hidrojen gazının sıcaklığının T K olması için hangi sıcaklığa getirilmelidir?
Çözüm:
Öncelikle H2 gazının başlangıç ve istenen sıcaklıkları oranını bulmalıyız:
-
Formül Uygulaması:
\frac{P_1V_1}{T_1} = \frac{P_2V_2}{T_2}Normal şartlar altında dengede sabit hacimli gazlar için basınçlar eşit kalır. Dolayısıyla buradan:
T_2 = T_1 \times \frac{n_2}{n_1}
- Burada, n_1 ve n_2 sürede mol sayısı, basınç değişmeyecek.
- Eğer He’ye göre bir çözüm yapıldıysa, He’nin mol sayısı aynı tutulmalı.
Sonuç: Gaz mol oranlarına göre, mulacke dengenin sağlanması için hidrojeni getirmeniz gereken sıcaklık belirlenir.
6. Soru
Soru:
SO3 gazının kütle oranı nedir?
Çözüm:
-
Gaz Mol Kütleleri:
- SO3: 80 g/mol
- Ne: 20 g/mol
-
Kütle Oranı Hesabı:
- İki gazın kütle oranı basitçe mol kütleleri oranına dayanır.
\frac{m_{\text{SO}_3}}{m_{\text{Ne}}} = \frac{80}{20} = 4
- Ancak burada eşit hacimlerdeki gazlardan bahsedildiğinden dolayı, aslında eşit hacim koşulları mol sayısı üzerinden de kontrol edilmelidir.
Sonuç: Kütle oranı ve hacimsel doluluk analizleri sonucunda, gazlar arasında orantı 4/1 olarak bulunur.
Final Sonuç
- 4. Soru: Her bir gaz mol sayısına bağlı olarak analiz edilmeli.
- 5. Soru: Hidrojen gazı başlangıç ve son durum sıcaklık değişimi tablosu içinde bulunsa dengenin sağlandığı sıcaklığa ulaşılır.
- 6. Soru: SO3 ve Ne arasındaki kütle oranı, mol kütleleri bazında 4:1 olarak hesaplanır.
Bu çözümleri bir arada tutarak soruları sistematik olarak ele alabiliriz. Ek bir soru ya da farklı bir konuda destek istersen, çekinmeden sorabilirsin!