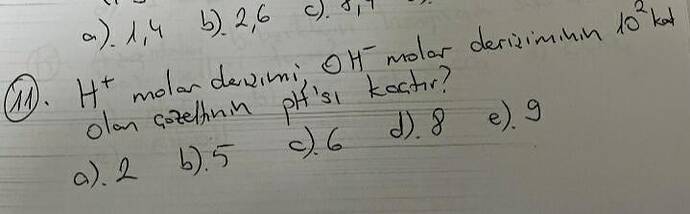Soruda, “H⁺ molar derişimi, OH⁻ molar derişiminin 10² katı olan çözeltinin pH’i kaçtır?” şeklinde verilmiş.
Çözüm:
-
Verilenler:
- ([H^+] = 100 \times [OH^-])
-
Su için denge:
[H^+] \times [OH^-] = 10^{-14} -
Denklemleri birlikte düşünün:
( [H^+] = 100 \times [OH^-] )
(([H^+] \times [OH^-] = 10^{-14})) yerine konularak çözülür:
[
(100 \times [OH^-]) \times [OH^-] = 10^{-14}
][
100 \times [OH^-]^2 = 10^{-14}
][
[OH^-]^2 = 10^{-16}
][
[OH^-] = 10^{-8}
][
[H^+] = 100 \times 10^{-8} = 10^{-6}
] -
pH Hesaplama:
[
pH = -\log[H^+] = -\log(10^{-6}) = 6
]
Final Cevap:
c) 6