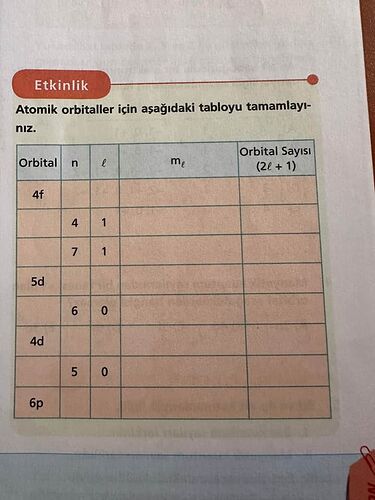
Lütfen resimle işlemli bir şekilde çözer misin
Atomik orbitaller için aşağıdaki tabloyu tamamlayınız.
Cevap:
Tablodaki her bir orbital için kuantum sayıları ve orbital sayısının hesaplanması gerekmektedir.
1. Orbital: 4f
- n (Principal Quantum Number): 4
- l (Azimuthal Quantum Number): f orbitali için ( l = 3 )
- ( m_l ) (Magnetic Quantum Number): ( m_l = -l, -(l-1), …, 0, …, (l-1), l ) yani, ( m_l = -3, -2, -1, 0, 1, 2, 3 )
- Orbital Sayısı: ( 2l + 1 = 2 \times 3 + 1 = 7 )
2. Orbital: 5d
- n (Principal Quantum Number): 5
- l (Azimuthal Quantum Number): d orbitali için ( l = 2 )
- ( m_l ) (Magnetic Quantum Number): ( m_l = -2, -1, 0, 1, 2 )
- Orbital Sayısı: ( 2l + 1 = 2 \times 2 + 1 = 5 )
3. Orbital: 4d
- n (Principal Quantum Number): 4
- l (Azimuthal Quantum Number): d orbitali için ( l = 2 )
- ( m_l ) (Magnetic Quantum Number): ( m_l = -2, -1, 0, 1, 2 )
- Orbital Sayısı: ( 2l + 1 = 2 \times 2 + 1 = 5 )
4. Orbital: 6p
- n (Principal Quantum Number): 6
- l (Azimuthal Quantum Number): p orbitali için ( l = 1 )
- ( m_l ) (Magnetic Quantum Number): ( m_l = -1, 0, 1 )
- Orbital Sayısı: ( 2l + 1 = 2 \times 1 + 1 = 3 )
Çözüm Tablosu:
| Orbital | n | l | ( m_l ) | Orbital Sayısı |
|---|---|---|---|---|
| 4f | 4 | 3 | -3, -2, -1, 0, 1, 2, 3 | 7 |
| 5d | 5 | 2 | -2, -1, 0, 1, 2 | 5 |
| 4d | 4 | 2 | -2, -1, 0, 1, 2 | 5 |
| 6p | 6 | 1 | -1, 0, 1 | 3 |
Bu şekilde, her bir orbital için kuantum sayıları ve orbital sayıları belirlenmiştir.