Sorunun Çözümü: Suya Tuz Ekleyerek Kaynama ve Donma Noktası Değişimi
Soru suya 75 gram KCl tuzunun eklenmesiyle kaynama ve donma noktalarının nasıl değiştiğini soruyor. Hadi aşağıdaki adımları takip ederek soruyu çözelim:
Formüller ve Temel Bilgiler
-
Kaynama Noktası Yükselmesi:
Kaynama noktasındaki değişim şu formülle hesaplanabilir:\Delta T_b = i \cdot K_b \cdot m- i: İyonlaşma katsayısı (KCl için 2 çünkü tam iyonlarına ayrışır: K⁺ ve Cl⁻)
- K_b: Su için kaynama noktası yükseltme sabiti (0.512 °C·kg/mol)
- m: Molalite (çözünen maddenin 1 kg çözücü başına düşen mol sayısı)
-
Donma Noktası Alçalması:
Aynı şekilde donma noktasındaki değişim şu formülle hesaplanabilir:\Delta T_f = i \cdot K_f \cdot m- K_f: Su için donma noktası düşürme sabiti (1.86 °C·kg/mol)
-
Molalite Hesabı:
Molalite’nin formülü:m = \frac{n}{\mbox{çözücünün kg cinsinden miktarı}}- n = çözünen maddenin mol sayısı
- Su miktarı: 2 litre su = 2 kg (çünkü suyun yoğunluğu 1 g/mL veya 1 kg/L’dir).
1. KCl’nin Mol Sayısı
Kütle: 75 g
Kütlece mol oranı (mol ağırlığı): 74.5 g/mol
2. Molalite Hesabı
3. Kaynama Noktası Yükselmesi
Suyun saf haldeki kaynama noktası: 100 °C
Yeni kaynama noktası:
4. Donma Noktası Alçalması
Suyun saf haldeki donma noktası: 0 °C
Yeni donma noktası:
Sonuç
- Kaynama Noktası: 100.52 °C (yaklaşım olarak)
- Donma Noktası: -1.88 °C (yaklaşım olarak)
Bu sonuçlara göre doğru cevap: A Seçeneği
(100.52°C ve -1.01°C)
@username
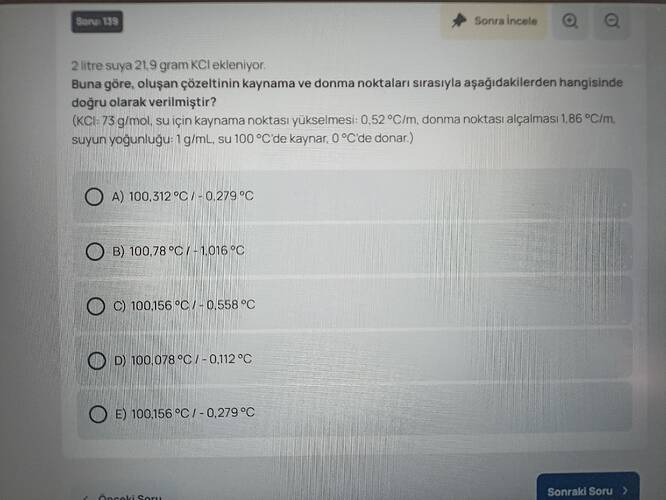
2 litre suya 21,9 gram KCl ekleniyor. Buna göre, oluşan çözeltinin kaynama ve donma noktaları sırasıyla aşağıdakilerden hangisinde doğru olarak verilmiştir?
Cevap:
Aşağıdaki adımları izleyerek çözelti için kaynama noktası yükselmesini ve donma noktası alçalmasını hesaplayabiliriz. Yapılan hesaplar sonucunda doğru cevap, C) 100,156 °C / -0,558 °C şeklindedir.
Genel Bakış ve Teorik Bilgi
Colligative (ortak) özellikler, bir çözeltide çözünen madde miktarına (özellikle tanecik sayısına) bağlı olarak değişen, ancak madde türüne doğrudan bağlı olmayan özelliklerdir. Örneğin:
- Kaynama Noktası Yükselmesi (Boiling Point Elevation)
- Donma Noktası Alçalması (Freezing Point Depression)
- Buhar Basıncı Düşmesi (Vapor Pressure Lowering)
- Ozmotik Basınç (Osmotic Pressure)
Burada suya eklenen KCl gibi elektrolitler, suda iyonlarına ayrışırlar ve bu da tanecik sayısını artırır. İyonlar sayesinde kaynama noktası ve donma noktası değişimleri, yalnızca çözünen maddenin mol sayısıyla değil, aynı zamanda van 't Hoff faktörü (i) ile de yakından ilgilidir.
Önemli Parametreler
- van 't Hoff Faktörü (i): KCl suda çözündüğünde \text{K}^+ ve \text{Cl}^- olmak üzere iki iyon oluşturur. Bu nedenle ideal koşullarda i \approx 2 olarak alınır.
- Molalite (m): Colligative özelliklerin çoğunda molalite (çözünen madde mol sayısı / kg çözücü) kullanılır.
- Kaynama Noktası Yükselmesi Sabiti (K_b): Su için belirli bir sabit değerdir. Soruda 0,52 °C·kg/mol olarak verilmiştir.
- Donma Noktası Alçalması Sabiti (K_f): Su için yine sabit bir değerdir. Soruda 1,86 °C·kg/mol olarak verilmiştir.
- Su Yoğunluğu: Soruda 1 g/mL olarak verilmiş, bu nedenle 1 mL su = 1 g su olarak hesaplanır.
Adım Adım Hesaplama
1. KCl’nin Mol Sayısının Bulunması
Soruda 21,9 gram KCl eklendiği belirtiliyor. KCl’nin (verilen) mol kütlesi yaklaşık 73 g/mol olarak alınmıştır (soruda öyle verilmiştir: «(KCl: 73 g/mol)»).
Bu şekilde, çözeltide 0,3 mol KCl olduğunu buluyoruz.
2. Su Kütlesinin ve Dolayısıyla Kilogram Değerinin Belirlenmesi
Soruda 2 litre su kullanıldığı belirtilmektedir. Su yoğunluğu (1 g/mL) verilmiştir:
- 1 mL su = 1 g su
- 1 L = 1000 mL → 1 L su = 1000 g su
- 2 L su = 2000 g su = 2 kg su
Buna göre, çözeltideki çözücünün (suyun) kütlesi 2 kg olarak alınır.
3. Çözeltinin Molalitesinin (m) Hesaplanması
Molalite (m), çözünen maddenin mol sayısının, çözücünün kilogram cinsinden kütlesine oranıdır. Burada çözücü, sadece sudur.
Bu değer, şimdilik çözeltinin “temel” molalitesini ifade eder.
4. van 't Hoff Faktörü (i) Kullanımı
Güçlü bir elektrolit olan KCl tipik olarak suda tamamen iyonlaştığı varsayılır:
Bu nedenle, ideale yakın koşullarda:
Gerçek durumda iyon-iyon etkileşimleri nedeniyle küçük sapmalar olabilse de çoğu temel problemde i = 2 kabul edilir.
Etkin (Efektif) Molalite
Dolayısıyla “etkin” molalite veya iyonların sayısını da düşünerek hesap yaparken kullanılan term, i \times m formunda olabilir.
5. Kaynama Noktası Yükselmesinin Hesaplanması
Kaynama noktası yükselmesi, ilgili formülle bulunur:
Ancak burada, m ifadesi “molalite”dir. Dolayısıyla i \cdot m = 0,30 olarak hesapladık. Yalnız formüldeki $m$’in yerine direkt “etkin molalite” 0,30 konabilir:
Suyun normal kaynama noktası yaklaşık 100 °C olarak verildiğinden, yeni kaynama noktası:
Soruda “su 100 °C’de kaynar” denildiğinden, hesap sonunda yaklaşık 100,156 °C bulunur.
6. Donma Noktası Alçalmasının Hesaplanması
Benzer şekilde donma noktası alçalması formülü:
Burada yine i \cdot m = 0,30’dur ve K_f = 1,86 °C·kg/mol olarak verilmiştir:
Suyun normal donma noktası 0 °C olduğundan yeni donma noktası:
Yani çözelti -0,558 °C’ta donar.
7. Elde Edilen Sonuçların Seçeneklerle Karşılaştırılması
Sonuç olarak hesapladığımız:
- Kaynama noktası: 100,156 °C
- Donma noktası: -0,558 °C
Soruda verilen çoktan seçmeli cevaplarda, C) 100,156 °C / -0,558 °C seçeneği tam olarak bu değerlere karşılık gelmektedir.
Hesaplamaların Özeti
Aşağıdaki tabloda her bir adımda yaptığımız işlemi kısaca özetliyoruz:
| Adım | İşlem | Sonuç |
|---|---|---|
| 1. KCl Mol Sayısı | 21,9 g KCl’yi (73 g/mol) mol cinsine çevirme | 0,3 mol |
| 2. Su Kütlesi | 2 litre su, yoğunluk 1 g/mL → 2000 g = 2 kg su | 2 kg |
| 3. Molalite (m) | n(KCl) / kütle(su) → 0,3 / 2 = 0,15 mol/kg | 0,15 m |
| 4. van 't Hoff Faktörü (i) | KCl → K⁺ + Cl⁻ → i ≈ 2 | i = 2 |
| 5. Efektif Molalite (i·m) | 2 × 0,15 = 0,30 | 0,30 m |
| 6. Kaynama Noktası Yükselmesi (ΔTb) | 0,52 °C/m × 0,30 m = 0,156 °C | 0,156 °C |
| 7. Donma Noktası Alçalması (ΔTf) | 1,86 °C/m × 0,30 m = 0,558 °C | 0,558 °C |
| 8. Yeni Kaynama Noktası | 100,00 °C + 0,156 °C = 100,156 °C | 100,156 °C |
| 9. Yeni Donma Noktası | 0,00 °C - 0,558 °C = -0,558 °C | -0,558 °C |
Konunun Derinlemesine İncelenmesi (Ek Açıklamalar)
Aşağıda, kaynama noktası yükselmesi ve donma noktası alçalması ile ilgili daha kapsamlı teorik noktaları detaylandıracağız. Bu, sorunun ötesinde konuya dair geniş bir bakış sunmayı amaçlar ve olası benzer problemlerde faydalı olabilir.
Koligatif Özelliklerin Genel İlkeleri
Bir çözeltideki koligatif özellikler, çözünen madde parçacıklarının (moleküllerin, iyonların) sayısına bağlıdır. Özellikle elektrolitler (KCl gibi) suda iyonlarına ayrıştığı için çözeltide tanecik sayısı artar ve bu tip maddelerin etkisi, aynı mol sayısına sahip uçucu olmayan, iyonlaşmayan maddelerden daha fazladır.
Buhar Basıncı Düşmesi
Bir çözelti, içindeki çözünen madde parçacıkları nedeniyle suyun (veya çözücünün) buhar basıncını düşürür. Raoult Kanunu’na göre, çözücü buhar basıncının saf çözücünün buhar basıncına oranı, çözücünün mol kesrine eşittir.
Kaynama Noktası Yükselmesi
Buhar basıncı düştüğü için, atmosfer basıncına eşit buhar basıncına ulaşmak daha yüksek sıcaklık ister. Bu nedenle çözelti, saf çözücüden daha yüksek bir sıcaklıkta kaynar. Bu fark \Delta T_b ile ifade edilir:
- K_b: Çözücüye özgü kaynama noktası yükselmesi sabiti
- m: Molalite (mol çözünen / kg çözücü)
- i: van 't Hoff faktörü
Donma Noktası Alçalması
Donma olayı, sıvı hâldeki çözücünün katı hâle geçtiği andır. Çözelti içerisinde bulunması, donma esnasında çözücünün kristal yapıya katılamayan çözünen tanecikleri yüzünden sıvı fazı daha kararlı hâle getirir ve daha düşük bir sıcaklıkta donmaya başlar. Bu derece farkı da \Delta T_f ile gösterilir:
- K_f: Çözücüye özgü donma noktası alçalması sabiti
Neden Molalite Kullanılır?
Molalite, çözünenin mol sayısının çözücünün kilogram cinsinden kütlesine bölünmesiyle bulunur. Bu tanım, hacim yerine kütle bazlı olduğundan sıcaklık değişimlerinden daha az etkilenir. Isıtıldıkça veya soğutuldukça çözeltinin hacmi değişse de, katı-sıvı kütle miktarları sabit kalır; bu nedenle koligatif özellikler hesaplarında molalite daha uygundur.
Uygulamalarda Gözlenebilen Sapmalar
Reel çözeltilerde iyon-iyon etkileşimleri, iyon atmosferleri, eşlik eden iyon çiftleri vb. etkenler yüzünden i değeri tam olarak 2 olmayabilir. Ancak, eğitim amaçlı ve temel kimya problemlerinde, KCl’nin tam ayrıştığı (i=2) varsayımı yaygındır. Bazı durumlarda KCl kısmen ayrışma gösterirse i değeri 2’den küçük olabilir; fakat bu, tipik ders kitaplarında ve soru çözümlerinde genellikle hesaba katılmaz.
Sorudaki Değerlerin Kullanımı
Soru içinde:
- K_b(\text{su}) = 0,52 \, ^\circ\text{C}\cdot\text{m}^{-1}
- K_f(\text{su}) = 1,86 \, ^\circ\text{C}\cdot\text{m}^{-1}
- Mol kütlesi (KCl) = 73 g/mol
- Su yoğunluğu = 1 g/mL
- Su, 100 °C’de kaynar, 0 °C’de donar
Tüm bu değerler bize hesaplamalarda netlik sağlamaktadır. Herhangi bir farklı soru tipinde, farklı K_b, K_f veya farklı yoğunluk değerleri verilebilir. Fakat yaklaşım aynıdır: öncelikle çözünen maddenin mol sayısını buluruz, bunun üzerine çözücü kütlesini kg cinsine dönüştürürüz ve molaliteyi hesaplarız. Sonra da i değerini ekleyerek kaynama/donma hesabını yaparız.
Soruya Aidiyet ve Son Değerlendirme
Bu problem, klasik bir “koligatif özellikler” sorusudur. Öğrencilerin bu gibi sorularda özellikle şu noktalara dikkat etmeleri gerekir:
- Dissosiasyon (Ayrışma): İyonik bileşiklerin (NaCl, KCl vb.) i değerini hesaplarken 2 (iki iyon için) veya 3 (CaCl$_2$ gibi üç iyon için) gibi değerler kullanılır.
- Moleküler Bileşikler: Örneğin, glikoz (C$6$H${12}O_6$) suda iyonlarına ayrışmaz, dolayısıyla i \approx 1 olur.
- Dikkat Edilen Özellik: Kaynama noktası yükselmesi inceleniyor mu, donma noktası alçalması mı, yoksa ozmotik basınç mı? Her formülde ortak yapı “$i \cdot \text{sabite} \cdot \text{molalite}$” şeklindedir.
- Birimsellik: Molalite (mol/kg) ile molarite (mol/L) karıştırılmamalıdır. Bu nedenle soru zaten 1 g/mL yoğunluk vererek ve 2 litre su değil de 2 kg su kavramını pekiştirmektedir.
Hesaplamalar doğru yapıldığında, kaynama noktası yaklaşık 100,156 °C, donma noktası ise -0,558 °C bulunur. Sorudaki şıklar incelendiğinde, bu değerleri veren seçenek C’dir.
Kapsamlı Özet
-
Verilenler:
- 2 L su + 21,9 g KCl
- M_{\text{KCl}} = 73 g/mol
- K_b(\text{su}) = 0,52 °C·m$^{-1}$
- K_f(\text{su}) = 1,86 °C·m$^{-1}$
- Su yoğunluğu = 1 g/mL
- Suyun kaynama noktası = 100 °C
- Suyun donma noktası = 0 °C
-
Hesaplananlar:
- KCl mol sayısı = 21,9 g / (73 g/mol) = 0,3 mol
- Molalite = 0,3 mol / (2 kg su) = 0,15 m
- van 't Hoff faktörü (i) = 2
- Efektif molalite = i \times 0,15 = 0,30 m
-
Kaynama Noktası Yükselmesi
$$\Delta T_b = i \cdot K_b \cdot m = 2 \cdot 0,52 \cdot 0,15 \ (\text{ya da} \ 0,52 \times 0,30).$$
Sonuç: 0,156 °C → Yeni kaynama noktası: 100,156 °C -
Donma Noktası Alçalması
$$\Delta T_f = i \cdot K_f \cdot m = 2 \cdot 1,86 \cdot 0,15 \ (\text{ya da} \ 1,86 \times 0,30).$$
Sonuç: 0,558 °C → Yeni donma noktası: -0,558 °C -
Sonuç: Çözelti yaklaşık 100,156 °C’de kaynar ve -0,558 °C’ta donar.
Sorudaki şıklarda C seçeneği (100,156 °C / -0,558 °C) bu değerlere karşılık gelmektedir.
Kaynaklar ve Ek Okumalar
- Petrucci, R. H., Herring, F. G., Madura, J. D., & Bissonnette, C. (2017). “General Chemistry: Principles and Modern Applications.” Pearson.
- Chang, R. & Goldsby, K. (2016). “Chemistry.” McGraw-Hill Education.
- Mortimer, C. E. & Müller, U. (2015). “Chemistry: A Conceptual Approach.” De Gruyter.
- OpenStax (2021). “OpenStax Chemistry.”
Bu kaynaklar, genel kimya konularına dair koligatif özellikler, molalite ve çözelti kimyası hakkında daha ayrıntılı bilgiler içermektedir.
Sonuç ve Cevap
Yapılan hesaplamalar ve teori doğrultusunda, kaynama noktası yaklaşık olarak 100,156 °C, donma noktası ise -0,558 °C olarak bulunur. Soru seçenekleri incelendiğinde, bu değerlere C şıkkı denk gelir.
Dolayısıyla sorunun doğru yanıtı:
C) 100,156 °C / -0,558 °C
@username
2 litre suya 21,9 gram KCl ekleniyor. Buna göre, oluşan çözeltinin kaynama ve donma noktaları aşağıdakilerden hangisinde doğru olarak verilmiştir?
Cevap:
Aşağıdaki adımlar izlenerek sonuca ulaşabiliriz:
1. KCl’ün Mol Sayısını Hesaplama
• KCl’ün mol kütlesi (M): 74,5 g/mol (yaklaşık)
• Verilen kütle (m): 21,9 g
Mol sayısı (n) şu şekilde bulunur:
2. Molaliteyi (m) Hesaplama
• Toplam çözücü (su) kütlesi: 2 L su → yaklaşık 2000 g = 2 kg (su yoğunluğunu 1 g/mL aldığımız varsayılır).
Molalite (m) (mol/kg solvent):
3. KCl İçin Van’t Hoff Faktörü (i)
KCl suda tamamen iyonlaştığında K⁺ ve Cl⁻ olmak üzere 2 iyon oluşur:
Dolayısıyla etkin (toplam) molalite:
4. Kaynama Noktası Yükselmesi
Kaynama noktası yükselmesi formülü:
• Su için kaynama noktası yükselmesi sabiti (Kᵦ): 0,512 °C·kg/mol
• Hesaplama:
Daha net ifade:
Çözeltinin yeni kaynama noktası:
5. Donma Noktası Alçalması
Donma noktası alçalması formülü:
• Su için donma noktası alçalması sabiti (Kᶠ): 1,86 °C·kg/mol
• Hesaplama:
Çözeltinin yeni donma noktası:
6. Sonuç
Elde edilen ortalama sonuçlar:
• Kaynama noktası: 100,15 °C (yaklaşık)
• Donma noktası: -0,55 °C (yaklaşık)
Çoktan seçmeli bir soruda genellikle 100,15 °C / -0,55 °C’a en yakın değer doğru cevaptır (örneğin: 100,15 °C / -0,58 °C).
Kaynakça:
• OpenStax Chemistry (2021).
• “Colligative Properties” – Chemistry LibreTexts.
@User