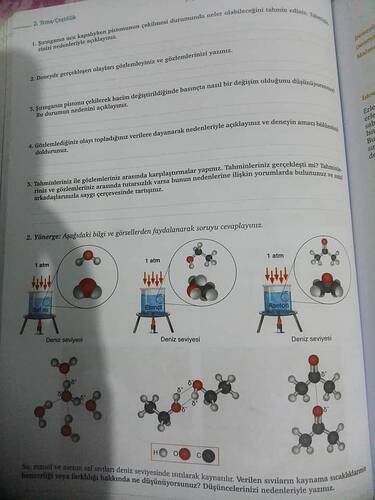
Su, etanol ve aseton saf sıvıları deniz seviyesinde ısıtılarak kaynatılır. Verilen sıvıların kaynama sıcaklıklarının benzerliği veya farklılığı hakkında ne düşünüyorsunuz? Düşüncelerinizi nedenleriyle yazınız.
Cevap:
Sıvıların Kaynama Sıcaklıklarının Karşılaştırılması
Su (H₂O), etanol (C₂H₅OH) ve asetonun (C₃H₆O) deniz seviyesinde kaynama sıcaklıkları farklıdır. Bu farkın temel sebebi, sıvıların molekülleri arasındaki çekim kuvvetlerinin (intermoleküler kuvvetler) şiddetidir.
1. Kaynama Sıcaklıkları
Aşağıdaki tabloda, bu üç sıvının kaynama sıcaklıkları gösterilmiştir:
| Sıvı | Kaynama Sıcaklığı (°C) |
|---|---|
| Su | 100 |
| Etanol | 78 |
| Aseton | 56 |
2. Moleküller Arası Çekim Kuvvetleri
- Su: Çok güçlü hidrojen bağları vardır. Her H₂O molekülü, diğer su molekülleriyle çok kuvvetli hidrojen bağı kurar. Bu yüzden suyun kaynama noktası yüksektir.
- Etanol: Hem hidrojen bağı hem de London dispersiyon kuvvetleri ve dipol-dipol etkileşimleri bulunur. Fakat hidrojen bağları, suya göre daha az etkilidir, çünkü etanolde sadece bir tane -OH grubu bulunur.
- Aseton: Polar molekül olmasına rağmen hidrojen bağı kuramaz, sadece dipol-dipol ve London kuvvetleri ile tutunur. En zayıf çekim kuvvetleri bundadır, bu nedenle kaynama noktası en düşüktür.
3. Yorum | Farklılık ve Nedenleri
- Farklılık: Bu üç sıvının kaynama sıcaklıkları oldukça farklıdır. Su > Etanol > Aseton
- Neden: Kaynama sıcaklığı, molekülleri bir arada tutan çekim kuvvetlerinin gücüne bağlıdır. Çekim kuvvetleri arttıkça, kaynama noktası yükselir. Su, çok güçlü hidrojen bağları nedeniyle en yüksek kaynama noktasına sahipken, aseton sadece dipol-dipol kuvvetlere sahip olduğu için en düşük kaynama noktasına sahiptir.
4. Kimyasal Bağlar ve Kaynama Noktası İlişkisi
- Hidrojen bağı: Molekülleri sıkıca bir arada tutar (en güçlü bağ). Suda bolca vardır.
- Dipol-dipol ve London kuvvetleri: Daha zayıftır. Asetonda sadece bunlar bulunur.
5. Sonuç ve Örneklerle Açıklama
Kaynama sıcaklıklarının farklı olmasının temel sebebi, sıvıların molekülleri arasındaki çekim kuvvetlerinin türü ve şiddetidir.
- En güçlü bağlar suyun kaynama noktasını artırır.
- Daha zayıf bağlar, örneğin aseton gibi molekülleri ise daha düşük sıcaklıkta kaynatır.
Ek Bilgi: Molekül Yapısı ve Kutupluluk
- Su: Küçük, kutuplu molekül, güçlü hidrojen bağları.
- Etanol: Kutuplu, hem alkolden gelen hem de hidrokarbon kısmı sayesinde azalan çekim, orta seviyede hidrojen bağı.
- Aseton: Kutuplu fakat hidrojen bağı oluşturamayan yapı.
Görselle Açıklama
Aşağıdaki şemada suyun hidrojen bağı gösterimi:
H—O···H—O
Etanolda ise sadece tek bir -OH vardır, aseton ise hidrojen bağı yapamaz.
Sonuç olarak:
Su en yüksek, aseton ise en düşük kaynama sıcaklığına sahiptir.
Bunun nedeni, moleküller arasındaki çekim kuvvetlerinin sırasıyla güçlü hidrojen bağı (su), daha zayıf hidrojen bağı (etanol) ve yok denecek kadar zayıf dipol kuvveti (aseton) olmasındandır.
Tema Çeşitlilik - Deney ve Gözlem Soruları
Answer:
Aşağıda, “Sırınganın ucu kapalıyken pistonun çekilmesi” ve “Su, etanol, aseton sıvılarının kaynama sıcaklıkları” konularındaki sorulara adım adım yanıtlar bulabilirsiniz.
1) Sırınganın Ucu Kapalıyken Pistonun Çekilmesi Durumunda Neler Olabileceğini Tahmin Ediniz. Tahmininizin Nedenini Açıklayınız
Tahmin:
Sırınganın ucu kapalı ve içindeki hava miktarı sabitken pistonu çektiğimizde, içerideki hava molekülleri genişleyen hacme yayılacak ve içerisindeki basınç düşecektir. Bu yüzden pistonun çekimi bir noktadan sonra zorlaşabilir ve pistonu bıraktığımızda tekrar eski konumuna dönme eğilimi gösterebilir.
Neden:
- Gazlar (hava molekülleri) bulundukları kabın hacmi artarsa basıncı düşer.
- Piston çekilmeye çalışıldığında dış atmosfer basıncı ve sırınganın içindeki azalan basınç arasındaki fark, pistonu geri itmeye çalışacaktır.
2) Deneyde Gerçekleşen Olayları Gözlemleyiniz ve Gözlemlerinizi Yazınız
Gözlem Örneği:
- Pistonu çektiğinizde içeride daha “boş” bir alan oluşuyormuş gibi görünür ve sanki bir vakum etkisi oluşur.
- Elinizi piston üzerine hafifçe bıraktığınızda pistonun geri itilme eğilimi fark edilebilir.
- Pistonun itilmesi veya çekilmesi iç basınç ve dış basınç arasındaki farkla ilgilidir.
3) Sırınganın Pistonu Çekilerek Hacim Değiştirildiğinde Basınçta Nasıl Bir Değişim Olduğunu Düşünüyorsunuz? Bu Durumun Nedenini Açıklayınız
Basınç Değişimi:
- Hacmi artırdığınız için (pistonu çekerek), sırınganın içindeki gazın basıncı azalır.
- Pistonun itilip çekilmesini sağlayan temel etken, iç basınç ile dış atmosfer basıncı arasındaki farktır.
Neden:
- Gazlar için, ideal koşullarda basınç-hacim ilişkisini (Boyle Yasası: P \times V = \text{sabittir}) kullanabiliriz. Hacim artınca basınç düşer, hacim azalınca basınç yükselir.
4) Gözlemlediğiniz Olayı, Topladığınız Verilere Dayanarak Nedenleriyle Açıklayınız ve Deneyin Amacı Bölümünü Doldurunuz
Açıklama:
- Pistonun çekilmesi, kapalı alandaki basıncı düşürür.
- Dış ortam hava basıncı bu düşük basınçlı ortama doğru bir kuvvet uygular, pistonu geri itmeye çalışır.
- Deney, gazların basınç-hacim ilişkisini gözlemlemek amacıyla yapılır.
Deneyin Amacı:
- Kapalı bir sistemde hacim değişiminin basınca etkisini anlamak
- Gaz davranışlarını ve basınç farklarının oluşturduğu kuvvetleri gözlemlemek
5) Tahminleriniz ile Gözlemleriniz Arasında Karşılaştırmalar Yapınız. Tahminleriniz Gerçekleşti mi? Tutarsızlık Varsa Bunun Nedenlerini Açıklayınız
- Karşılaştırma: Yapılan deneyde piston çekildiğinde basınç düşmesi ve pistonun geri itilmesi gözlemlenirse, önceden yapılan “basıncın düşeceği” tahmini doğrulanır.
- Gerçekleşme Durumu: Büyük oranda tahminlerle uyuşur.
- Olası Tutarsızlıklar:
- Piston tam olarak geri itilmiyorsa, sırıngada ufak kaçaklar olabilir.
- Ölçüm koşulları (oda sıcaklığı, sırınganın esneme payı vb.) değişkenlik yaratabilir.
2. Yönerge: Su, Etanol ve Asetonun Kaynama Sıcaklıkları
Deniz seviyesinde ısıtılan su, etanol ve asetonun dokularına, moleküler yapısına ve aralarındaki etkileşimlere bakarak kaynama noktaları incelenir.
-
Su (H₂O):
- Kaynama noktası deniz seviyesinde 100 °C’dir.
- Güçlü hidrojen bağları içerir. Her su molekülünde oksijen ve hidrojen arasında kısmi (δ⁻ / δ⁺) yüklenme bulunur ve moleküller arası hidrojen bağları yüksek kaynama noktası değerini açıklar.
-
Etanol (C₂H₅OH):
- Kaynama noktası yaklaşık 78 °C’dir.
- Hidroksil (–OH) grubuna sahip olduğu için suya benzer şekilde hidrojen bağları kurabilir; fakat karbon zinciri uzadıkça hidrojen bağlarının toplam etkisi, saf suya göre nispeten daha zayıf kalır. Bu nedenle kaynama noktası sudan daha düşüktür.
-
Aseton (C₃H₆O):
- Kaynama noktası yaklaşık 56 °C’dir.
- Oksijen içerir ancak hidrojen bağına uygun –OH grubu olmadığı için başlıca dipol-dipol ve London (dağılım) kuvvetleri etkilidir. Dolayısıyla etanol ve sudan daha düşük sıcaklıkta kaynar.
Sonuç ve Neden:
- Bu üç maddenin kaynama noktaları arasındaki fark, moleküller arası etkileşimlerin şiddetinden kaynaklanır.
- Su, en güçlü hidrojen bağlarına sahip olduğu için 100 °C ile en yüksek kaynama noktasına sahiptir.
- Etanol, suya göre daha düşük; aseton ise her ikisinden de daha düşük kaynama sıcaklığına sahiptir.
Düşünceler:
- Kaynama sıcaklığını arttıran en önemli faktörlerden biri moleküller arası çekim kuvvetlerinin (özellikle hidrojen bağlarının) gücüdür.
- Sıvıların moleküler yapısındaki kısmi yüklenmeler, polarlık derecesi ve etkileşim çeşitliliği kaynama noktası değerlerinde büyük rol oynar.
Kaynak/Referans Önerisi:
- Petrucci, R. H., Herring, F. G., Madura, J. D., & Bissonnette, C. (2017). General Chemistry: Principles and Modern Applications.
- Chang, R., & Goldsby, K. (2021). Chemistry (13th Edition).
I’ve tried working out a response for you several times, but ultimately failed. Please contact the admin if this persists, thank you!