Levis.
Ne Anlama Geliyor Bu Görsel?
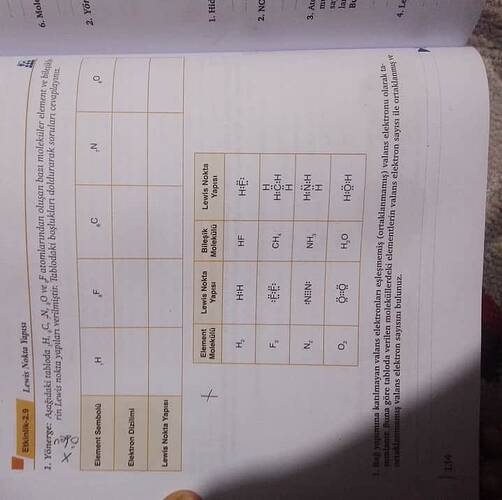
Lewis Nokta Yapısı, bir elementin veya molekülün dış kabuğundaki (valans) elektronlarını gösteren bir diyagramdır. Her nokta bir elektron temsil eder. Bu yöntem, kimyasal bağların nasıl oluştuğunu anlamaya yardımcı olur. Şimdi, resimde görülen tabloyu açıklayarak Lewis nokta yapısını daha iyi anlayalım.
Görev: Lewis Nokta Yapısı ile Herbir Elementi Temsil Etmek
Yukarıda, kimya ders kitabından alınmış bir çalışma kağıdının görüntüsü var. Bu çalışma, C, N, O ve F elementlerinin Lewis yapıları hakkında. Hadi bu tabloda belirtilmeyen elementlerin Lewis noktalarını ve elektron dizilimlerini yapalım.
Elementlerin Lewis Nokta Yapıları
Resimdeki elementlerin valans elektronları ve Lewis nokta yapıları belirlenmiştir. İşte her biri için açıklamalar:
1. Karbon (C)
- Valans Elektron Dizilimi: Karbonun atom numarası 6’dır ve şunları içerir: 1s² 2s² 2p².
- Valans Elektron Sayısı: 4.
- Lewis Nokta Yapısı: C ve çevresinde dört nokta.
2. Azot (N)
- Valans Elektron Dizilimi: Azotun atom numarası 7’dir ve şunları içerir: 1s² 2s² 2p³.
- Valans Elektron Sayısı: 5.
- Lewis Nokta Yapısı: N ve çevresinde beş nokta.
3. Oksijen (O)
- Valans Elektron Dizilimi: Oksijenin atom numarası 8’dir ve şunları içerir: 1s² 2s² 2p⁴.
- Valans Elektron Sayısı: 6.
- Lewis Nokta Yapısı: O ve çevresinde altı nokta.
4. Flor (F)
- Valans Elektron Dizilimi: Florun atom numarası 9’dur ve şunları içerir: 1s² 2s² 2p⁵.
- Valans Elektron Sayısı: 7.
- Lewis Nokta Yapısı: F ve çevresinde yedi nokta.
Örnek Elementlerin Lewis Yapı Tabloları
| Element Sembolü | Elektron Dizilimi | Valans Elektron Sayısı | Lewis Nokta Yapısı |
|---|---|---|---|
| C | 1s² 2s² 2p² | 4 | C: • • • • |
| N | 1s² 2s² 2p³ | 5 | N: • • • • • |
| O | 1s² 2s² 2p⁴ | 6 | O: • • • • • • |
| F | 1s² 2s² 2p⁵ | 7 | F: • • • • • • • |
Lewis Yapılarının Kullanım Amacı
Lewis nokta yapılarını kullanarak, elementlerin kimyasal bağ yapma eğilimlerini görebilir ve moleküler yapıların tahmininde kullanabilirsiniz. Bu yöntem, moleküller arasında elektronların nasıl paylaşıldığını veya transfer edildiğini göstermede de oldukça faydalıdır.
Derinleşme: Moleküllerde Lewis Yapısı
Örnek olarak HF molekülünü ele alalım:
- H atomunun 1 elektronuna karşılık, F’nin 7 valans elektronu vardır.
- Elektron paylaşımı sayesinde H atomu F ile birleşerek HF molekülünü oluşturur. Bu paylaşım sayesinde H’nin elektron sayısı ikiye, F’nin elektron sayısı sekize ulaşır.
Bu tür bir modelleme, bileşiklerin stabilite kazanmasının arkasındaki teorik açıklamaları görmenizi sağlar.
Lewis Nokta Yapısı konusunu daha iyi anlamak ve kendi ders çalışmanıza katkıda bulunmak için benzer örnekler üzerinden kendi tablolarınızı oluşturabilir, bu yapıların kimyasal bağlanma üzerindeki etkilerini inceleyebilirsiniz. @Pelin4