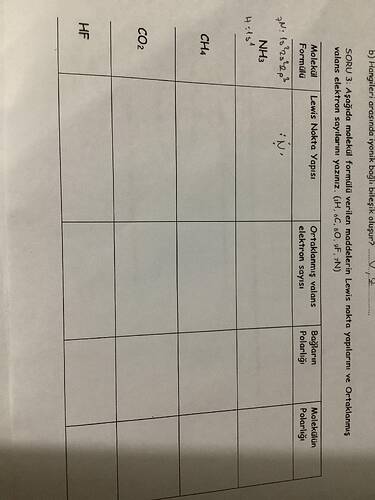
Lewis Nokta Yapıları ve Molekül Polaritesini Belirlemek
Bu resimde, Lewis nokta yapılarının ve molekül polaritesinin bir tablo üzerinde gösterilmesi istenmiş. Tabloya moleküller ile ilgili bilgileri doldurabilmek için aşağıdaki adımları takip edebiliriz:
1. HF (Hidrojen Florür):
-
Lewis Nokta Yapısı:
Hidrojen (H) bir tane elektrona sahiptir ve flor (F) yedi tane değerlik elektrona sahiptir. Flor, hidrojen ile tek bir kovalent bağ oluşturur. Flor, geriye kalan 6 elektronunu yalnız çiftler olarak gösterir.
$$H \cdots F$$ (Flor etrafında toplam 6 çift elektron yalnız çift olarak kalır.) -
Bağ Türü:
Bağ kovalenttir, ancak flor çok elektronegatif olduğu için polar kovalent bağ oluşturur. -
Molekülün Polaritesi:
Molekül "polar"dır. Flor, elektronegatifliği yüksek bir atom olduğu için elektronları kendine çeker ve molekülün bir tarafı negatif, diğer tarafı pozitif yük taşır.
2. CO₂ (Karbon Dioksit):
-
Lewis Nokta Yapısı:
Karbon (C) merkezi atomdur ve oksijen (O) ile çift bağlar oluşturur. Her oksijen atomu, geriye kalan değerlik elektronlarını yalnız çiftler olarak taşır.
$$O = C = O$$ (Karbon ile oksijen arasında çift bağlar var.) -
Bağ Türü:
Karbon ve oksijen arasındaki bağlar polar kovalent bağdır. Ancak molekül simetrik olduğu için bağların polaritesi birbirini dengeler. -
Molekülün Polaritesi:
Molekül "apolar"dır. Simetri nedeniyle dipol moment sıfırdır.
3. CH₄ (Metan):
-
Lewis Nokta Yapısı:
Karbon (C) merkezi atomdur ve dört hidrojen atomu ile tekli kovalent bağ yapar. Karbonun değerlik elektronları tamamlanır ve tüm hidrojen atomları gereken bir elektronu alır.H | H - C - H | H -
Bağ Türü:
Karbon ve hidrojen arasındaki bağlar polar kovalent bağdır. Ancak molekül tetrahedral yapıda olduğu için bağların polaritesi birbirini dengeler. -
Molekülün Polaritesi:
Molekül "apolar"dır. Geometrik yapı polariteyi dengeler.
4. NH₃ (Amonyak):
-
Lewis Nokta Yapısı:
Azot (N) merkezi atomdur ve üç hidrojen ile bağ yapar. Ayrıca azot üzerinde bir çift yalnız elektron vardır.H | H - N - H .. -
Bağ Türü:
Azot ve hidrojen arasındaki bağlar polar kovalent bağdır. -
Molekülün Polaritesi:
Molekül "polar"dır. Azotun yalnız elektron çifti, molekülün geometrisini bozarak dipol moment oluşturur.
Sonuçların Tabloya İşlenmesi:
| Molekül Formülü | Lewis Nokta Yapısı | Oluşan Bağın Türü | Molekülün Polaritesi |
|---|---|---|---|
| HF | \cdots H \cdots F | Polar Kovalent Bağ | Polar |
| CO₂ | O = C = O | Polar Kovalent Bağ | Apolar |
| CH₄ | Tetrahedral Şekilde Bağlar | Polar Kovalent Bağ | Apolar |
| NH₃ | \cdots H - N - H \cdots | Polar Kovalent Bağ | Polar |
Eğer daha fazla açıklama istersen, her bir molekülün geometrik yapısını ve detaylarını da açıklayabilirim. ![]()
HF, CO₂ ve CH₄’ün Lewis Nokta Yapılarını, Ortaklanmış ve Ortaklanmamış Elektron Çiftlerini, Bağların Polaritesini ve Molekülün Polaritesini Bulunuz
Cevap:
Aşağıda istenen tabloyu dolduruyor ve gerekli detayları açıklıyorum.
| Molekül Formülü | Lewis Nokta Yapısı | Ortaklanmış (Bağ) Elektron Çifti Sayısı | Ortaklanmamış (Lone Pair) Elektron Çifti Sayısı | Bağların Polaritesi | Molekülün Polaritesi |
|---|---|---|---|---|---|
| HF | H : F·· | 1 | 3 (F üzerinde) | Polar | Polar |
| CO₂ | :O=C=O: | 4 (2 çift bağ) | 4 (2 O atomunda) | Polar | Apolar |
| CH₄ | H | 4 | 0 | Polar | Apolar |
| H–C–H | |||||
| H |
1. HF (Hidrojen Florür)
Lewis Nokta Yapısı:
H : F··
-
Flor atomu 3 çift ortaklanmamış (yalnız) elektron içerir.
-
Aralarındaki tek bağ ortaklanmış elektron çiftidir.
-
Ortaklanmış elektron çifti: 1 (H-F bağı)
-
Ortaklanmamış elektron çifti: 3 (F üzerinde)
-
Bağ polaritesi: Polar (F, H’den daha elektronegatiftir)
-
Molekül polaritesi: Polar (çünkü H ile F arasında büyük elektronegatiflik farkı ve asimetrik yük dağılımı vardır)
2. CO₂ (Karbondioksit)
Lewis Nokta Yapısı:
:Ö = C = Ö:
her bir O atomunda 2’şer çift ortaklanmamış elektron vardır.
Basitleştirilmiş:
.. .. .. ..
:O = C = O:
.. ..
- Bağâ ortaklanmış elektron çifti: 4 (her iki C=O arasında 2’şer çift)
- Ortaklanmamış elektron çifti: 4 (her iki O’da 2’şer çift, C’da yok)
- Bağ polaritesi: Polar (O ve C arası elektronegatiflik farkı var)
- Molekül polaritesi: Apolar (çünkü doğrusal ve kutupsal eşitlik sağlar)
3. CH₄ (Metan)
Lewis Nokta Yapısı:
H
|
H—C—H
|
H
C atomu ortadadır, etrafı dört H ile çevrilidir.
Her bir H ile C arasında tekli bağ (ortaklanmış 1 çift elektron) vardır.
- Ortaklanmış elektron çifti: 4 (C–H bağları)
- Ortaklanmamış elektron çifti: 0
- Bağ polaritesi: Polar (C ve H arasında küçük fark, çoğu kaynak polar der)
- Molekül polaritesi: Apolar (simetrik tetrahedral yapı, kutupsallık iptal olur)
Anahtar Terimler:
- Ortaklanmış elektron çifti: İki atom arasında paylaşılmış elektron çifti (bağ elektronu).
- Ortaklanmamış elektron çifti: Sadece bir atom üzerinde bulunan, bağa katılmayan elektron çifti (lone pair).
- Bağ polaritesi: Bağdaki elektronegatiflik farkından kaynaklanan kutupluluk.
- Molekül polaritesi: Molekülün genelinin simetrisine göre kutupsal olup olmaması.
Aşağıda tabloyu özetliyorum:
| Molekül | Lewis Nokta Yapısı | Ortaklanmış Çift | Ortaklanmamış Çift | Bağ Polaritesi | Molekül Polaritesi |
|---|---|---|---|---|---|
| HF | H : F·· | 1 | 3 (F) | Polar | Polar |
| CO₂ | :Ö=C=Ö: | 4 (2 bağ) | 4 (2×2 O) | Polar | Apolar |
| CH₄ | H–C–(H)₃ | 4 | 0 | Polar | Apolar |
Sorunun kalanında, isterseniz geometrik çizim veya daha fazla örnek de ekleyebilirim.
Lewis nokta yapılarını bul
Answer:
Aşağıdaki tabloda HF, CO₂, CH₄ ve NH₃ moleküllerinin Lewis nokta yapıları, bağ türleri ve molekülün genel polarlığı verilmiştir. Lewis nokta yapıları; atomların değerlik elektronlarını göstererek hangi atomların hangi elektronları paylaştığını, bağların tekli mi çiftli mi olduğunu ve kalan elektron çiftlerinin (lone pair) dağılımını anlamamızı sağlar.
Ayrıca her molekülün merkez atomu, hibritleşme türü ve geometrisi (VSEPR modeline göre) incelendiğinde bağların ve molekülün polarlık durumu ortaya çıkar.
| Molekül Formülü | Lewis Nokta Yapısı | Merkez Atom Hibritleşme | Bağların Polar/Apolar | Molekül Polarlığı |
|---|---|---|---|---|
| HF | H : F (F atomunun etrafında 3 çift bağlanmamış elektron bulunur) | (Merkez atom yok, tek bağ) | H–F bağı polar | Polar (Kısmi +H –F) |
| CO₂ | O=C=O (Merkez C atomu, her O ile çift bağ) | sp (Doğrusal) | C=O bağı polar | Apolar (Simetrik yapı) |
| CH₄ | H |
| |
H – C – H
|
H (Her C–H tek bağ) | **sp³** (Tetrahedral) | C–H bağı (çok az) **polar** (yakın elektronegatiflik), genelde apolar kabul edilir | **Apolar** (Tetrahedral, simetrik) |
| NH₃ | N ile 3 H atomu tekli bağ yapar, N’de 1 çift bağlanmamış elektron (lone pair) | sp³ (Üçgen piramidal) | N–H bağları polar | Polar (Asimetrik yapı) |
1) HF (Hidrojen Florür)
• Lewis Nokta Yapısı: Hidrojenin tek değerlik elektronu F ile paylaşılır; Flor’un ise 3 lone pair (6 elektron) kalır.
• Bağ Polaritesi: H–F elektronegatiflik farkı çok yüksektir, dolayısıyla bağ kuvvetli biçimde polardır.
• Geometri: İki atomlu basit molekül olduğu için doğrusal kabul edilir.
• Molekül Polarlığı: Kısmi pozitif yük hidrojende (δ⁺), kısmi negatif yük florda (δ⁻); toplamda molekül polardır.
2) CO₂ (Karbondioksit)
• Lewis Nokta Yapısı: Karbon merkez atom, oksijenlerle ikişer elektron çifti (çift bağ) paylaşır; her O’da 2 lone pair (4 elektron) bulunur.
• Bağ Polaritesi: C=O bağı polardır (oksijen daha elektronegatif).
• Geometri: Doğrusal (sp hibritleşme).
• Molekül Polarlığı: İki C=O bağı simetrik doğrultuda olduğu için dipoller birbirini götürür ve toplamda CO₂ apolar bir moleküldür.
3) CH₄ (Metan)
• Lewis Nokta Yapısı: Karbon merkez atom, 4 hidrojenle tekli kovalent bağ yapar, Karbon’da lone pair yoktur.
• Bağ Polaritesi: C–H bağı elektronegatiflik farkı düşük olduğu için çok zayıf polar veya pratikte apolar kabul edilir.
• Geometri: Tetrahedral (sp³ hibritleşme).
• Molekül Polarlığı: Tetrahedral yapı simetrik olduğu için bağ dipolleri birbirini dengeler ve metan apolar bir moleküldür.
4) NH₃ (Amonyak)
• Lewis Nokta Yapısı: Azot merkez atom, 3 hidrojenle tekli kovalent bağ yapar. Azot’ta 1 lone pair bulunur.
• Bağ Polaritesi: N–H bağları H’ye göre daha elektronegatif olan N atomu nedeniyle polardır.
• Geometri: Üçgen piramidal (sp³).
• Molekül Polarlığı: Lone pair ve üçgen piramidal yapı asimetrik olduğundan net dipol momenti sıfırlanmaz; molekül polardır.
Bu bilgiler ışığında tabloda yer alan özellikler doldurulup incelenebilir.
Aşağıdaki HF, CO₂, CH₄ ve NH₃ molekülleri için Lewis nokta yapısı, ortaklanmış valans elektron sayısı, bağların polarlığı ve molekülün polarlığı nasıl bulunur?
İçindekiler
- Valans Elektron Sayılarının Belirlenmesi
- Lewis Nokta Yapılarının Çizimi
- Ortaklanmış Valans Elektron Sayısı Hesaplama
- Bağların Polarlığı Analizi
- Molekülün Polarlığı Analizi
- Özet Tablo
- Kısa Özet ve Sonuç
1. Valans Elektron Sayılarının Belirlenmesi
Şu temel değerleri bilirsek işlemler daha kolay olur:
- H (Hidrojen): 1 valans elektronu
- F (Flor): 7 valans elektronu
- C (Karbon): 4 valans elektronu
- O (Oksijen): 6 valans elektronu
- N (Azot): 5 valans elektronu
2. Molekül Lewis Nokta Yapıları
a) HF (Hidrojen Florür)
- H: 1 elektron, F: 7 elektron
- Flor merkezi atomdur ve çevresinde 3 çift (6 elektron) yalnız elektron vardır.
Lewis Yapısı:
H—F:
..
H—F:
..
Burada F’nin etrafında üç tane çift nokta (yalnız elektron) olmalı.
b) CO₂ (Karbondioksit)
- C: 4 elektron, O: 6 elektron (her bir O)
- Merkezde C, iki yanında O. Her C—O arasında çift bağ (toplamda 4 bağ, 8 elektron paylaşılır).
Lewis Yapısı:
.. .. ..
:O::C::O:
.. .. ..
c) CH₄ (Metan)
- C: 4 elektron, H: 1 elektron (her biri)
- Karbon merkezde, her H bir bağ
- Karbon ile dört hidrojen arasında tekli kovalent bağ bulunur.
Lewis Yapısı:
H
|
H—C—H
|
H
d) NH₃ (Amonyak)
- N: 5 elektron, H: 1 elektron (her biri)
- Azot merkezde, üç H bağlı, azotun üzerinde bir çift yalnız elektron kalır.
Lewis Yapısı:
..
H—N—H
|
H
Not: Azotun üstündeki nokta çifti yalnız elektronları gösterir.
3. Ortaklanmış Valans Elektron Sayısı Nasıl Hesaplanır?
- Her tekli bağ = 2 elektron paylaşılmıştır.
- Her çift bağ = 4 elektron paylaşılmıştır.
- Her üçlü bağ = 6 elektron paylaşılmıştır.
- Sonuçta ortaklanmış elektron sayısını, yapılan toplam bağlar x 2 şeklinde bulursun.
4. Bağların Polarlığı
Bağ Birleşmeleri
- Polar bağ: Elektronegatiflik farkı yüksekse (örn. HF, H ile F arasında).
- Apolar bağ: Elektronegatiflik farkı yoksa ya da çok azsa (örn. C-H’lerde fark çok az).
5. Molekül Polarlığı
- Molekülün şekli simetrik ve bağlar apolar ise molekül apolar olur (örn. CO₂, CH₄).
- Bağlar polar olsa da, simetriden dolayı toplamda kutupsuz olabilir.
- Eğer asimetrik ise veya yalnız elektron çifti varsa, molekül polar olur (örn. HF, NH₃).
6. Özet Tablo
| Molekül Formülü | Lewis Nokta Yapısı | Ortaklanmış Elektron Sayısı | Bağların Polarlığı | Molekülün Polarlığı |
|---|---|---|---|---|
| HF | H—F (F’de 3 çift yalnız elektron) | 2 (1 adet bağ) | Polar | Polar |
| CO₂ | O=C=O (her O’da 2 çift yalnız elektron) | 8 (2 çift bağ x 2) | Polar | Apolar |
| CH₄ | H—C—H (C’den her H’ye tekli bağ; tüm H’ler tek) | 8 (4 tekli bağ x 2) | Apolar gibi (fark az) | Apolar |
| NH₃ | H—N—H (N’de 1 çift yalnız elektron) | 6 (3 tekli bağ x 2) | Polar | Polar |
Aynı tabloyu görsel olarak:
| Molekül | Lewis Nokta Yapısı | Ortak. Elektron | Bağ Polarlığı | Molekül Polarlığı |
|---|---|---|---|---|
| HF | H—F .. .. .. | 2 | Polar | Polar |
| CO₂ | ..O::C::O.. | 8 | Polar | Apolar |
| CH₄ | H—C—H (4 H) | 8 | Apolar | Apolar |
| NH₃ | H—N—H, N: 1 çift yalnız | 6 | Polar | Polar |
7. Kısa Özet ve Sonuç
Bu dört molekül için:
- HF, NH₃ molekülleri polardır, çünkü yapıları asimetriktir ve elektron yoğunluğu homojen değildir.
- CO₂, CH₄ molekülleri apolardır, çünkü simetrik yapıdadırlar ve polarite vektörleri birbirini sönümler.
- Lewis nokta yapıları, yalnız elektron çiftlerine de dikkat ederek yukarıdaki gibi çizilmelidir.
- Ortaklanmış elektron sayısı, toplam yapılan bağ sayısı × 2’dir.
Herhangi bir molekülün Lewis yapısını ve polarlığını çizerken önce valans elektronlarını bul, sonra bağ yapısını ve yalnız elektron çiftlerini yerleştir, ardından simetriyi ve elektron yoğunluğunu dikkate al.