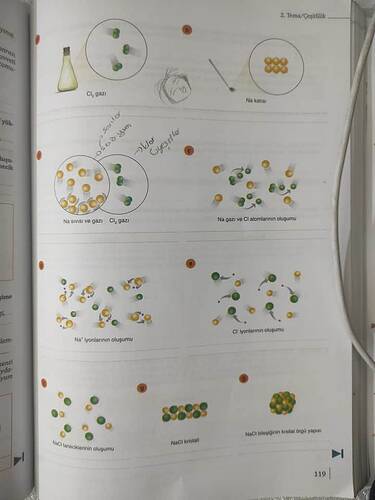
Bu görselde, sodyum (Na) ve klor (Cl) elementlerinin etkileşimi ve sodyum klorür (NaCl) yapısının oluşumu görsel olarak anlatılmaktadır. Her bir bölüm, bu kimyasal sürecin farklı aşamalarını temsil etmektedir. Şimdi bu aşamaları detaylı bir şekilde açıklayalım:
Aşamalar
a. Cl₂ Gazı:
- Burada, klor gazı iki atomdan oluşan diatomik bir molekül şeklinde gösterilmiştir. Klor molekülü, doğada genellikle bu şekilde bulunur.
b. Na Katısı:
- Bu bölüm, sodyum elementinin katı hali olarak temsil edilmiştir. Sodyum, alkali metaller grubuna dahil bir elementtir ve oda sıcaklığında katı formda bulunur.
c. Na Sıvısı ve Gazı, Cl₂ Gazı:
- Burada, sıvı sodyum ve gaz halindeki klor bir aradadır. Karışım, sodyum atomlarının ve klor moleküllerinin devam etmekte olan bir tepkimeye işaret edebilir.
d. Na Gazı ve Cl Atomlarının Oluşumu:
- Bu aşamada, sodyum atomlarının gaz haline geçtiği ve klor moleküllerinin ayrı atomlara dönüştüğü gösterilir. Bu süreç kimyasal bir tepkimenin başlangıcını temsil eder.
e. Na⁺ İyonlarının Oluşumu:
- Sodyum atomları elektron kaybederek Na⁺ iyonları haline gelir. Bu olay, diğer adıyla oksidasyon, elektron kaybı sonucu pozitif yüklü iyonların oluşumudur.
f. Cl⁻ İyonlarının Oluşumu:
- Aynı anda klor atomları elektron kazanarak Cl⁻ iyonları oluşturur. Bu olay, elektron alışını ve negatif yüklü iyonların oluşumunu içeren bir redüksiyon sürecidir.
g. NaCl Taneciklerinin Oluşumu:
- Sodyum ve klor iyonları elektrostatiği kuvvetlerle bir araya gelerek NaCl formunda, yani sofra tuzu olarak bilinen sodyum klorür taneciklerini oluşturur.
h. NaCl Kristali:
- Bir araya gelen iyonlar düzenli kristal yapılar oluşturur. Bu kristal yapı, iyonların belirli bir düzenle yerleştiği simetrik bir örgüdür.
i. NaCl Bileşiğinin Kristal Örgü Yapısı:
- Son aşamada, NaCl bileşiğinin kristal örgü yapısı açıkça gösterilir. Bu yapı, iyonların düzenli bir şekilde üç boyutlu bir örgüde yer aldığı hâlidir.
Bu kimyasal süreç, iyonik bağların oluşumu ve katı bir kristal yapı ile sonuçlanmaktadır. İyonik bağlar, genellikle bir metal ve bir ametal arasında oluşur ve bu bağ, yüksek erime noktalarına ve karakteristik kristal yapılarına sahip bileşiklerin oluşmasını sağlar. NaCl, doğada sıkça rastlanan ve geniş bir kullanım alanına sahip bir bileşiktir.
Bu süreci etkin bir şekilde anlamak, kimya derslerinde iyonik bağları ve kristal yapıların özelliklerini öğrenmek açısından büyük önem taşır. Başka soruların varsa, sormaktan çekinme!