Bu soruyu çözerek kimya ile ilgili tüm gerekli detayları açıklayacağım. Lütfen biraz bekleyin!
Sorunun Çözümü ve Analizi:
Soru, periyodik tablo bilgisi ve elektron dağılımı ile ilgili. Şimdi adım adım ilerleyelim ve verilen ifadeleri doğrulayalım.
Verilen Bilgiler:
Elektron dağılımı 3d⁵ ile sona eren ve +1 yüklü iyon oluşmuş X elementiyle ilgili aşağıdaki ifadeler inceleniyor:
- 4. periyot, VIII B grubunda
- Periyodik sistemin d bloğunda
- 11 Y elementi ile YX bileşiğini oluşturabilir
Bu ifadelerin doğruluğunu periyodik tablo ve element özellikleri üzerinden adım adım değerlendireceğiz:
Adım 1: Elektron Yerleşimi ve Element Belirleme
Bir elementin elektron dağılımı 3d⁵ şeklindeyse bu, iyon halindeki dağılıma işaret eder.
X elementinin nötr hali:
[Ar] 4s² 3d⁵
Bu, nötr mangan (Mn) elementinin dağılımıdır. Manganın +1 yüklü iyonu oluştuğunda 4s orbitalinde bir elektron çıkar:
Mangan (Mn):
- Atom numarası: 25
- Grup: VIIIB grubu (triyotlu geçiş metalleri).
- Periyot: 4. periyot (d bloku).
Adım 2: İfadelerin Doğru Analizi
I. İfade: 4. periyot, VIII B grubunda
Mangan VIIIB grubunda yer alır (Trit geçiş metalleri grubu: Mn, Fe, Co). Ayrıca periyodik tablonun 4. periyotunda bulunur. Bu ifade kesinlikle doğrudur.
II. İfade: Periyodik sistemin d bloğunda
Mangan bir geçiş metali olduğu için elektron dağılımı 3d orbitalinde olur ve d bloğunda yer alır. Bu ifade de kesinlikle doğrudur.
III. İfade: 11 Y elementi ile YX bileşiğini oluşturabilir.
Y elementi s blok elementi 11. grup alkali metal (Na) olabilir. Alkali metaller geçiş metalleriyle bileşik oluşturabilir. Bu yüzden mangan Na ile bileşik oluşturabilir. Örneğin, NaMnO₄ gibi. Bu ifade de doğrudur.
Sonuç:
Doğru ifadeler: I, II ve III
Doğru cevap: E) I, II ve III
Bu tür kimya sorularını çözerken daima periyodik tablo, elektron dağılımı, element grupları ve blok bilgilerini dikkate almanız gerekir.
Eğer başka benzer sorularınız varsa yardımcı olmaktan mutluluk duyarım!
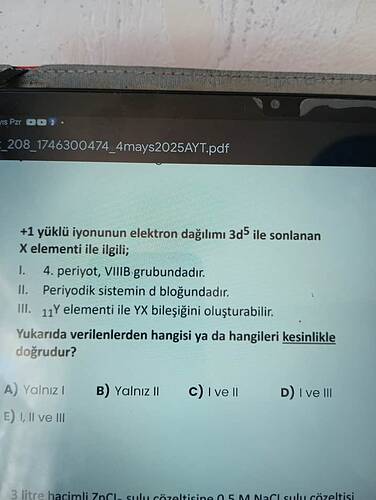
+1 yüklü iyonunun elektron dağılımı 3d⁵ ile sonlanan X elementi ile ilgili; hangisi/hangileri kesinlikle doğrudur?
Cevap:
Soruda, **“+1 yüklü iyonunun elektron dağılımı 3d⁵ ile sonlanan X elementi”**nden bahsediliyor. Bu ifadenin ne anlama geldiğini adım adım inceleyelim:
1. İyonun Elektron Dizilimi ve Elementin Bulunması
- X^{+1} iyonu: 3d^5 ile bitiyor.
- Nötr halde, bir elektron fazla olacak; yani nötr atomun elektron dizilimi [Ar] 4s^2 3d^5 olacak.
- Bu, krom (Cr) elementini ifade eder. Ancak dikkat, kromda istisnai dizilim vardır: [Ar] 4s^1 3d^5.
- Normalde [Ar] 4s^2 3d^4 olurdu fakat elektron dizilimi yarı dolu d-orbitalini tercih eder.
Fakat iyonun dağılımı 3d^5 olduğuna göre, muhtemelen mangan (Mn) da olabilir:
- Nötr mangan: [Ar] 4s^2 3d^5
- Mn^{+1}: [Ar] 4s^1 3d^5
- Mn^{+2}: [Ar] 3d^5
Ama soruda açıkça “3d⁵ ile SONLANAN +1 iyon” deniyor. Yani 4. periyot, 7B grubu, d bloğu bir elementtir: Mangan (Mn).
2. Şıkları Analiz Edelim
I. 4. periyot, VIIIB grubundadır.
- Mangan, 4. periyot, VIIA (7B) grubunda yer alır.
- Ancak “VIIIB grubu” ifadesi yanlıştır. VIIIB grubu 8, 9, 10. gruplar için eski sistemde kullanılan isim; mangan 7B (eski sisteme göre) yani bugünkü 7. grup.
- Bu ifade yanlıştır.
II. Periyodik sistemin d blokundadır.
- Mangan (ve Cr gibi geçiş metalleri) d bloğundadır.
- Bu ifade kesinlikle doğrudur.
III. _{11}Y elementi ile YX bileşiğini oluşturabilir.
- _{11}Y ifadesi yanlış, fakat burada _{11} sembolünün sodyum (Na, atom numarası 11) olduğunu varsayıyoruz.
- Mangan (ve/veya bu yapıdaki d-blok elementleri) genellikle sodyum ile iyonik bileşik oluşturabilirler (ör: NaMnO4 gibi).
- Ancak bu ifade olağandır ama “kesinlik” içermez; çünkü bütün d-blok elementleri tüm elementlerle bileşik oluşturmayabilir.
- Oluşturulabilir demek, kesin bilgi vermez.
3. Doğru Seçenek
- Kesinlikle doğru olan yalnızca II. maddedir.
Doğru cevap:
B) Yalnız II
Önemli Notlar ve Kavramlar
| Elektron Dizilimi | Periyot | Grup | Blok |
|---|---|---|---|
| [Ar]4s^2 3d^5 | 4 | 7B (veya 7. grup) | d-bloku |
- d bloğu: 3. (Sc) ile 12. (Zn) grupları kapsar, geçiş metalleridir.
- Periyot: n değeridir, burada 4. periyot.
- Grup numarası: d-blokları, eski sistemde B tipi ile belirtilir (örn: 7B = 7. grup).
- Bileşik oluşturma genel olarak mümkündür ama “kesinlikle” demek için yetmez.
Kısacası:
- I. yanlıştır (grup yanlış ifade edilmiş)
- II. doğrudur (d-bloku)
- III. kesinlik içermez
Doğru cevap:
B) Yalnız II
**+1 yüklü iyonunun elektron dizilimi 3d⁵ ile biten X elementi ile ilgili;
I. 4. periyot, VIIIB grubundadır.
II. Periyodik sistemin d bloğundadır.
III. 11₋Y elementi ile YX bileşiğini oluşturabilir.
Yukarıdakilerden hangisi/ hangileri kesinlikle doğrudur?**
Çözüm Adımları
- X⁺ iyonunun elektron dizilimi→ [Ar] 3d⁵
‑ Ar (argon) çekirdeğinden sonra 3d alt kabuğunda 5 elektron bulunduğu anlamına gelir. - Nötr X atomunun dizilimi
‑ X⁺, bir elektron kaybetmiş durumdadır. Kayıp genellikle önce 4s kabuğundan olur.
‑ Dolayısıyla nötr X atomu [Ar] 3d⁵ 4s¹ konfigürasyonuna sahiptir.
‑ Elektron sayısı: 18 (Ar) + 5 (3d) + 1 (4s) = 24 → Z = 24 → X = Cr (krom). - İfadelerin doğruluğu
I. “4. periyot, VIIIB grubu”
‑ Cr periyodik tabloda 4. periyotta doğru.
‑ Ancak Cr, VIIIB değil VIB grubundadır (eski B sınıflamasına göre VIB = IUPAC 6. grup).
‑ Yanlış.
II. “d bloğundadır.”
‑ 3d elektronları içerdiği için Cr kesinlikle d bloğu elementidir.
‑ Doğru.
III. “11₋Y elementi ile YX bileşiği oluşturabilir.”
‑ 11. element Na’dır. Na–Cr (NaCr) türünde kararlı bir bileşik oluşturulamaz (yük uyumsuzluğu, olağan bileşik yapısı yoktur).
‑ Yanlış.
Sonuç olarak sadece II. ifade doğrudur.
Özet Tablosu
| İfade | Değerlendirme | Açıklama |
|---|---|---|
| I. 4. periyot, VIIIB grubu | Yanlış | Periyot OK, fakat Cr grup VIB’de yer alır. |
| II. Periyodik sistemin d bloğunda | Doğru | [Ar]3d⁵ konfigürasyonu d blok elementidir. |
| III. 11₋Y (Na) ile YX bileşiği yapar | Yanlış | Na–Cr türünde kararlı bir bileşik olmaz. |
Doğru seçenek: B) Yalnız II
+1 yüklü iyonunun elektron dağılımı 3d⁵ ile sonlanan X elementi sorusu
Soru:
“+1 yüklü iyonunun elektron dağılımı 3d⁵ ile sonlanan X elementi ile ilgili:
I. 4. periyot, VIIIB grubundadır.
II. Periyodik sistemin d bloğundadır.
III. ¹¹Y elementi ile YX bileşiğini oluşturabilir.
Yukarıda verilenlerden hangisi veya hangileri kesinlikle doğrudur?”
Cevap: B) Yalnız II
Neden “Yalnız II”?
-
Elektron Dağılımından Yola Çıkma
+1 yüklü X⁺ iyonunun son katmanlarında “3d⁵” elektron dizilimi verilmiştir. Bu, nötr haldeki elementin d-blok metal olduğunu ve 4. periyotta yer aldığını gösterir. Ancak “3d⁵” dağılımına sahip +1 yüklü iyon, genellikle krom (Cr) veya mangan (Mn) gibi elementlerde elektron çıkarma sırasına göre görülebilir.- Cr (Z=24) nötr halde [Ar] 3d⁵ 4s¹ biçimindedir. 1 elektron kaybettiğinde (Cr⁺) [Ar] 3d⁵ hâline gelir.
- Mn (Z=25) nötr halde [Ar] 3d⁵ 4s² biçimindedir ve 1 elektron verdiğinde [Ar] 3d⁵ 4s¹ hâlinde kalması beklenir (enerji düzeyleri incelenince 4s elektronu önce gider fakat genellikle +1 iyonu kararlı olmayabilir).
Sonuç olarak, “3d⁵” konfigürasyonundan yola çıkarak, X elementinin d-blokta olduğuna (yani geçiş metaline) kesin gözüyle bakılır.
-
(I) 4. periyot, VIII B grubundadır
-
- periyotta olup da eski sistemle “VIII B” (yeni sistemde “8. grup”) olarak adlandırılan element demir (Fe), kobalt (Co) veya nikel (Ni) olabilir. Fakat bu elementlerin +1 iyonları 3d⁵ biçiminde bitmez. Örneğin:
- Fe nötr: [Ar] 3d⁶ 4s²
Fe⁺: [Ar] 3d⁶ 4s¹ (3d⁵ değil)
- Dolayısıyla 3d⁵ dağılımı, 4. periyot VIII B grubundaki (eski sisteme göre) Fe, Co, Ni gibi elementlere uymamaktadır. Bu ifade kesin bir doğruluk taşımaz.
-
-
(II) Periyodik sistemin d bloğundadır
- 3d⁵ dizilimi kesinlikle d-blok (geçiş metalleri) elementlerine aittir. Bu yüzden (II) ifadesi doğrudur.
-
(III) ¹¹Y elementi (sodyum, Na vb.) ile YX bileşiği oluşturabilir
- ¹¹ numaralı element sodyum (Na) olduğuna göre “NaX” gibi bir bileşik söz konusu olabilir. Fakat “NaX” formülünün olup olmaması, hangi geçiş metalinden bahsettiğimize ve hangi değerlikleri aldığına göre değişir. Örneğin krom/sodyum bileşikleri tek değerlikli (NaCr) şeklinde pek görülmez; mangan ya da diğer geçiş metallerinde de benzer durum geçerlidir. Bu ifade, “kesinlikle” doğru diyemeyeceğimiz, kararlılık ve değerlik elektronlarına bağlı bir durumdur.
Dolayısıyla periyodik sistemin d bloğunda olduğu (II) mutlaktır; ancak (I) ve (III) “kesinlikle” doğru kabul edilemez. Cevap bu nedenle B) Yalnız II olur.