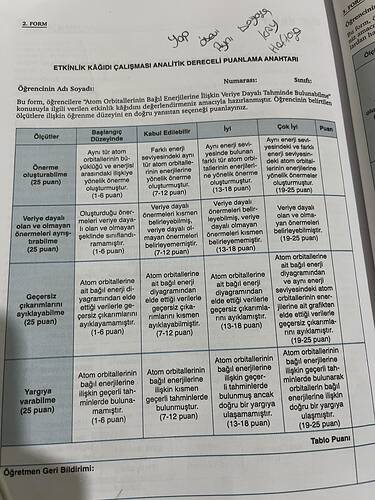
Atom orbıtallerinin bağıl enerjilerine iliskın veriye dayalı tahminde bulunabilme tabloya göre örnek çözümleme
Atom Orbitallerinin Bağıl Enerjilerine İlişkin Veriye Dayalı Tahmin ve Çözümleme
Atom orbitalleri, elektronların bir atom içerisinde bulunma olasılığının en yüksek olduğu bölgeleri ifade eder. Bu bölgelerin enerjileri benzersiz ve sistematiktir. Atom orbitallerinin enerjisi n ve l kuantum sayıları ile belirlenir.
1. Atom Orbitalleri ve Enerji Seviyeleri
-
Kuantum Sayıları:
- Baş Kuantum Sayısı (n): Elektronun ana enerji seviyesini belirtir. n sayısı arttıkça enerji seviyesi de artar.
- Açısal Momentum Kuantum Sayısı (l): Elektronun alt kabuğunu ifade eder ve değerleri 0’dan (s orbitali) n-1’e (p, d, f) kadar değişir.
-
Enerji Seviyeleri:
- Orbitallerin enerji seviyeleri sıralandığında, genelde (1s < 2s < 2p < 3s < 3p < 4s < 3d) şeklinde bir sıra izlenir. Bu sıralama, orbitallerin enerji seviyelerini belirlerken başvuracağımız temel bir kuraldır.
2. Önerme ve Yargıya Varabilme
-
Veriye Dayalı Önerme Yapabilme:
- Tabloya göre, farklı enerji seviyesindeki atom orbitallerini ve enerjilerini karşılaştırarak önerme oluşturulabilir. Bu tür öneriler, orbitallerin enerji seviyeleri arasında yapılan bir hiyerarşik kıyaslamadır. Örneğin, (2p) orbitalinin (3s) orbitalinden daha düşük enerjiye sahip olması gibi.
-
Yargıya Varabilme:
- Atom orbitallerinin enerji seviyelerine ilişkin geçerli tahminlerde bulunma yetisi, diyagram ve grafikler üzerinden elde edilen verilerle kuvvetlendirilebilir. Örneğin, enerji diyagramlarından yola çıkarak hangi orbitallerin doldurulmasının daha avantajlı olduğu belirlenebilir.
3. Ölçme ve Değerlendirme Analizi
- Önerilerin ve yargıların geçerliliği, öğrencinin yaptığı analiz ve değerlendirmeye bağlı olarak değişir.
- Önerme oluşumunda: Öğrenci, atom orbitallerine dayalı doğru tahminlerde bulunmalıdır.
- Geçerli çıkarımlar yapabilme: Grafiklerden ve enerji diyagramlarından elde edilen verilerin doğru yorumlanması gereklidir.
4. Örnek Çözümleme
- Örneğin:
- Bir enerji diyagramında (3s) ve (3p) orbitallerinin enerji düzeylerini karşılaştırarak, hangi orbitalin daha düşük enerjiye sahip olduğunu değerlendirebilirsiniz.
- Veri Analizi: Elde edilen veriler ışığında (3p) orbitalinin (3s) orbitalinden daha yüksek enerjiye sahip olduğu sonucuna varabiliriz, çünkü p orbitalleri, aynı baş kuantum sayısına sahip s orbitallerine göre daha yüksek energilidir.
5. Çıkarımlar ve Gözlemler
- Atom orbitalleri arasındaki enerji farklılıkları, elektronların dizilimini ve dolayısıyla atomların kimyasal özelliklerini etkiler. Elektronlar daha düşük enerji seviyeli orbitalleri önce doldurarak, atomun en kararlı hali almasını sağlar.
Özet: Atom orbitallerinin bağıl enerjilerine ilişkin yapılan analiz ve değerlendirmeler, öğrencinin bilinçli ve veriye dayalı çıkarımlar yapar. Bu da kimyasal reaksiyonların ve atom yapı taşlarının daha iyi anlaşılmasına olanak sağlar.