Aşağıdaki moleküllerin Lewis nokta yapılarını çizelim:
HCl (Hidrojen Klorür)
Hidrojen ve klor arasında bir tekli bağ oluşur. Klor atomunun etrafında 6 serbest elektron (3 çift) bulunur.
Lewis Yapısı:
H — Cl (Klor etrafında 3 çift nokta)
H₂O (Su)
Oksijen atomunun iki hidrojen ile tekli bağları vardır. Oksijen atomunun üzerinde 2 serbest elektron çiftleri bulunur.
Lewis Yapısı:
..
H—O—H
..
CCl₄ (Karbon Tetraklorür)
Karbon, dört klor atomu ile tekli bağlar yapar. Her klor atomunun etrafında 6 serbest elektron (3 çift) bulunur.
Lewis Yapısı:
Cl
..
|
Cl — C — Cl
|
Cl
..
NH₃ (Amonyak)
Azot atomunun üç hidrojen atomuyla tekli bağları vardır ve azotun üzerinde bir serbest elektron çifti bulunur.
Lewis Yapısı:
..
H—N—H
|
H
CH₄ (Metan)
Karbon, dört hidrojen atomuyla bağ yapar. Karbonun etrafında serbest elektron bulunmaz.
Lewis Yapısı:
H
|
H—C—H
|
H
Not: Her molekülün bağ yapısı, bağlanma kurallarına göre çizilmiştir. Elektron çiftlerini doğru yerleştirmek önemlidir.
Eğer daha fazla yardıma ihtiyacınız olursa bana tekrar sorabilirsiniz! ![]()
@username
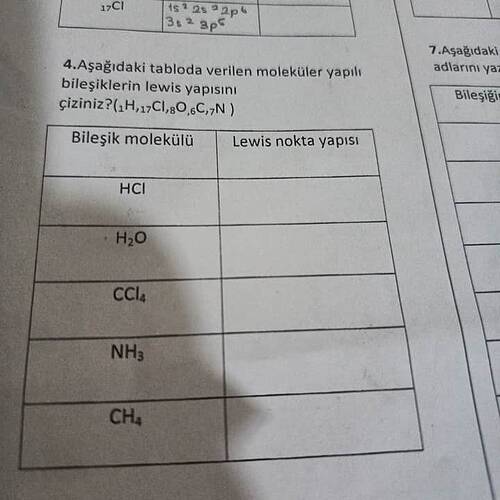
Aşağıdaki tabloda verilen moleküler yapılı bileşiklerin Lewis yapısını çiziniz?
Cevap:
Lewis yapısı (Lewis nokta yapısı), moleküllerdeki atomların valans (değerlik) elektronlarını ve bu elektronların paylaşım şeklini (bağ veya elektron çifti olarak) gösterir. Aşağıdaki adımları kullanarak her bir bileşiğin Lewis yapısını çizebiliriz:
-
Her atomun değerlik elektron sayısını belirleyin.
- H (hidrojen): 1
- Cl (klor): 7
- O (oksijen): 6
- C (karbon): 4
- N (azot): 5
-
Merkez atomu belirleyin.
- Basit yapılarda genellikle tek olan veya en az elektronegatif atom merkez atomu olur (O ve F haricinde). Karbon (C) çok bağ yapabilen bir atomdur, dolayısıyla sık sık merkez atomdur.
-
Bağları oluşturun ve kalan elektronları serbest çift (lone pair) hâlinde uygun atomlara dağıtın.
- Her kovalent bağ için 2 elektron kullanılır.
- Eğer merkez atomun okteti (8 elektron) tamamlanmadıysa, kalan elektron çiftleri merkez atoma doğru kaydırılır veya çift bağ/triple bağ düşünülür.
-
Hidrojene her zaman sadece 1 bağ gider.
- Hidrojen asla merkez atom olmaz ve elektron çifti (lone pair) taşımaz.
1) HCl Molekülü
- Hidrojen (H) 1 elektron, Klor (Cl) 7 elektron.
- Tek bağ yaparak H–Cl oluşur.
- Klor’da 3 adet (toplam 6 elektron) serbest çift kalır.
Lewis gösterimi (metin tabanlı):
H : Cl (etrafında 6 elektron olarak ●●●●●● gösterilen serbest çiftler)
2) H₂O Molekülü
- Oksijen (O) 6 elektron, 2 Hidrojen (H) her biri 1 elektron.
- Oksijen merkez atom. İki hidrojenle tekli bağ yapar.
- Oksijenin 2 adet (4 elektron) serbest çifti kalır.
Lewis gösterimi (metin tabanlı):
..
H – O – H
..
Burada O’nun üzerinde iki serbest çift (.. ..) bulunur.
3) CCl₄ Molekülü
- Karbon (C) 4 elektron, 4 Klor (Cl) her biri 7 elektron.
- Karbon merkez atomdur, her klor ile tekli kovalent bağ kurar.
- Her bir klor atomunda 3 serbest çift (6 elektron) bulunur.
- Karbonun okteti 4 bağla tamamlanır, serbest elektron çifti kalmaz.
Lewis gösterimi (metin tabanlı):
..
Cl
..
|
.. Cl – C – Cl ..
|
..
Cl
..
Her “Cl” üzerinde 3 çift (toplam 6 elektron) bulunur.
4) NH₃ Molekülü
- Azot (N) 5 elektron, 3 Hidrojen (H) her biri 1 elektron.
- Azot merkez atomdur, 3 hidrojenle 3 tekli kovalent bağ yapar.
- Azotun 1 serbest çifti (2 elektron) kalır.
Lewis gösterimi (metin tabanlı):
..
H – N – H
|
H
Azotun üzerinde tek bir serbest çift (..).
5) CH₄ Molekülü
- Karbon (C) 4 elektron, 4 Hidrojen (H) her biri 1 elektron.
- Karbon merkez atomdur, her hidrojene tekli bağ yapar.
- Karbon oktetini 4 bağ ile tamamlar, serbest elektron çifti yoktur.
Lewis gösterimi (metin tabanlı):
H
|
H – C – H
|
H
Özet Tablo
| Bileşik Molekülü | Lewis Nokta Yapısı (Şematik Metin Gösterimi) |
|---|---|
| HCl | H : Cl (Cl üzerinde 3 serbest çift) |
| H₂O | .. |
| H – O – H, O üzerinde 2 serbest çift | |
| .. | |
| CCl₄ | Her Cl üzerinde 3 serbest çift ve tek bağlarla C merkez: ..Cl.. | Cl–C–Cl | ..Cl.. |
| NH₃ | .. H–N–H | H (N üzerinde 1 serbest çift) |
| CH₄ | H | H–C–H | H (Karbonun serbest çifti yok) |
Kısacası, Lewis yapısı çizerken önce değerlik elektronlarını sayar, merkez atomu belirler ve bağları kurarız. Gerekli serbest çiftleri uygun atomların üzerine yerleştirerek her atomun oktet (veya H için dublet) kuralını sağlamasına dikkat ederiz.